
背景
原发性肺癌按照病理类型可分为四类:肺腺癌、肺鳞癌、大细胞肺癌和小细胞肺癌。目前,免疫联合治疗被推荐用于驱动基因阴性的晚期非小细胞肺癌(NSCLC)。大细胞肺癌(LCLC)属于NSCLC的一种,多发于外周,在病理上和其他发生于中心型的肺癌有很大区别。最近的研究表明,人类白细胞抗原(HLA)对新生抗原呈递至关重要,它可以激活宿主免疫系统,对抗病原体和肿瘤细胞。此外,HLA的杂合性缺失(LOH)高度参与了肿瘤进化中的免疫逃逸机制,并可能预测NSCLC免疫治疗的不良反应。然而,目前关于LCLC中HLA的LOH的报道较少。重庆医科大学附属第三医院汪天虎教授团队报道了一例LCLC患者接受免疫治疗的罕见案例。手术后,可能由HLA LOH诱发的免疫逃逸,从而导致该患者出现了多处暴发性身体和口腔肿瘤转移。但是,该患者接受了信迪利单抗联合安洛替尼的联合治疗后,仍然获得长达1年的持久PR。相关研究成果发表在Frontiers in Oncology(IF=6.244),裕策生物参与其中基因检测与数据解析工作。
案例展现
诊断
68岁,非吸烟女性患者,因出现咳嗽、痰血、轻微呼吸短促,2019年6月入院就诊。经CT检查显示(图1A)显示在右侧肺下叶只有一个肿块,无支气管或淋巴结病变。该患者最初被诊断为Ⅰb期LCLC 。但是,出乎意料的是该患者却在术后1个月后出现右上臂(图1B)、右肘、右腰和舌根全身多发性的转移。该患者的血清神经元特异性烯醇化酶(NSE)从12.12 ng/ml增加到30.14 ng/ml。因此,该患者被确诊为 Ⅳb期LCLC。
检测
该患者使用裕策生物的YuceOne® Plus产品进行基因检测和PD-L1检测,发现其右下叶原发灶和右上臂体转灶PD-L1表达水平(TPS)分别为60-70%(图1A)和40-49%(图1B)。基因检测数据显示:右下叶原发灶和右上臂体转灶的肿瘤突变负荷(TMB)分别为2.01 Muts/Mb和5.36 Muts/Mb;右下叶原发灶和右上臂体转灶都检测到PBRM1 L1230P(突变频率分别为 2.65% 和63.18%) 和 TP53 L194R (突变频率分别为 5.14%和 57.96%)的突变;右下叶原发灶的HLA基因分型为HLA-A*02:03、HLA-A*11:01、HLA-B*55:02、HLA-B*40:01、HLA-C*12 :03 和 HLA-C* 07:02,但在右上臂转移灶中除了HLA- A*11:01、HLA-B* 40:01和 HLA-C*07:02,其他同时出现LOH。此外,使用裕策生物的TruNeoTM算法预测 PBRM1 L1230P 的突变肽 TEIPENDIPL 是一种特定的新生抗原,并且仍然可以在两个病灶中由 HLA-B*40:01 进行呈递。
治疗
2019年7月,考虑到免疫治疗预测性生物标志物的中等表达(PD-L1 表达水平<50% 和 TMB <10 muts/Mb)和暴发性转移,该患者接受信迪利单抗(200 mg)加依托泊苷(100 mg/m2,d1~ 3)-洛铂(50 mg/kg, d1) 的治疗,随后患者出现恶心、呕吐、乏力等几种典型的化疗副作用,因此患者拒绝进一步的化疗。之后,患者左背部虽又有新病灶,左锁骨淋巴结肿大,但肺部未见异常。2019年8月,该患者改用信迪利单抗(200 mg)加抗血管生成剂安罗替尼(12 mg)联合免疫治疗,经过1个周期的治疗,身体多处病灶缩小。2019年10月连续治疗3个周期后,血清NSE水平逐渐下降至16.63 ng/ml(图2A),口腔病灶(图2B)消失,多脏器未见异常(图2C)。根据随访结果,该患者一直耐受联合免疫疗法,并获得了长达一年的持久 PR。
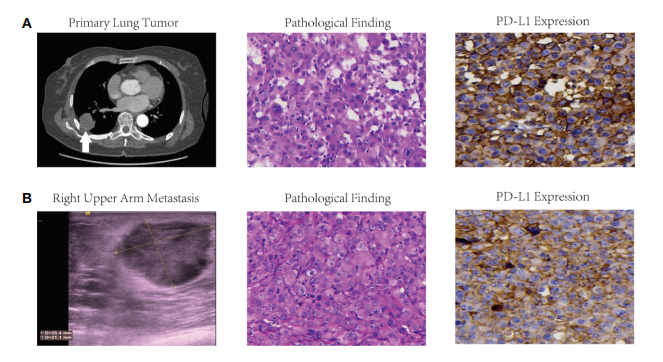
图1. 患者的原发性肺肿瘤 (A) 和右上臂转移灶 (B) 的影像学发现、病理结果和 PD-L1 表达
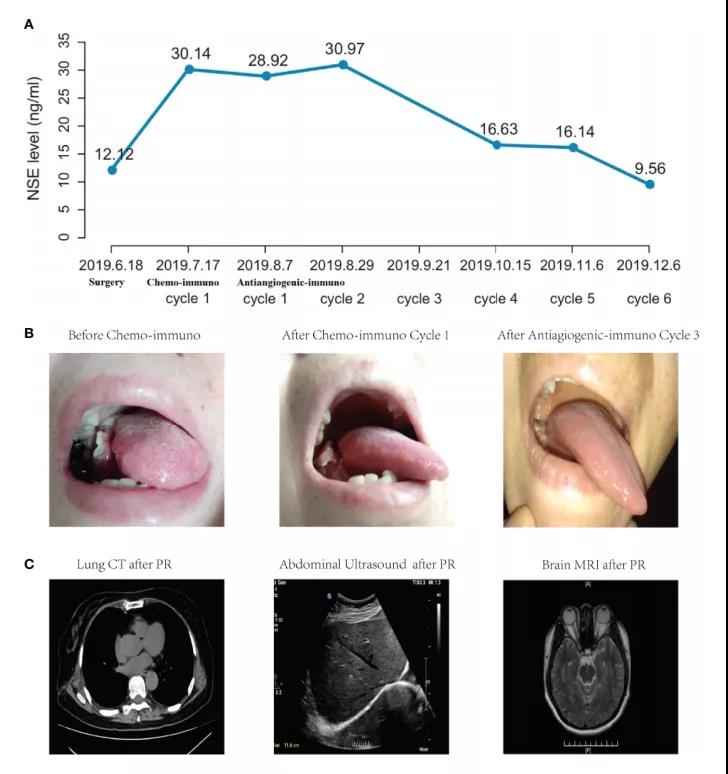
图2.患者NSE水平(A)、口腔转移 (B) 和多器官 (C) 的临床结果
结语
PD-1抑制剂或抗CTLA4抗体的免疫治疗已成为一种有前途的治疗策略。与其他常见的非小细胞肺癌不同,LCLC的免疫治疗潜在分子机制和治疗效果尚不清楚。
值得注意的是,该患者免疫治疗预测生物标志物中等表达以及无特异性驱动基因突变,但却在右上臂转移灶中检测到HLA LOH。已发表在Cell 上的文章同样证实 HLA LOH更常见于转移病灶而不是原发病灶,这表明HLA LOH发生可能导致肿瘤转移。由此可见,通过对患者原发灶和转移灶基因测序的探索,证实了HLA LOH 在免疫逃逸中扮演重要作用。
与此同时,使用TruNeoTM算法预测出的来源 PBRM1 L1230P 突变的特异性新生抗原TEIPENDIPL,仍然可以在两个病灶中由 HLA-B*40:01 进行呈递,这将有可能为个性化治疗提供潜在的治疗靶点。
专家点评
据研究报道,大约50%的LCLC患者缺乏驱动突变。此外,80%的LCLC患者为PD-L1阳性表达(TPS >1%),免疫治疗可能为LCLC患者提供了潜在治疗选择。本案例患者PD-L1中等或高表达,由于转移灶(右上臂体转灶)存在HLA LOH强阳性,对信迪利单抗联合依托泊苷治疗表现出耐药,证实了HLA LOH在免疫逃逸中扮演重要作用。据我们所知,这是首例在LCLC中从HLA LOH角度探究临床相关性以及免疫联合抗血管生成药物治疗的案例。目前LCLC治疗没有明确的指南,本病例提示免疫治疗联合抗血管生成药物可能为无驱动基因突变的晚期LCLC患者提供一种潜在的有效的治疗选择。
专家介绍

汪天虎教授
重庆医科大学附属第三医院胸外科主任
呼吸疾病中心副主任
外科学博士
主任医师、硕士研究生导师
兼任
中国医药教育协会营养专业委员会常务委员
重庆市医学会胸心外科学分会副主任委员
重庆抗癌协会纵隔肿瘤专业委员会副主任委员
重庆市医药技术协会肺癌专委会副主任委员
重庆市中西医结合学会胸外科专委会常务委员
中国胸外科三维重建及人工智能联盟常务委员
重庆市医师协会胸外科分会委员
重庆市中西医结合学会肿瘤专委会委员
重庆医学会微创专委会胸外科学组委员
重庆抗癌协会肺癌专委会委员
中国医师协会胸外医师分会数字医学及应用学组(筹)副组长
Copyright©2021
深圳裕策生物科技有限公司 版权所有
粤ICP备16128839号

