
导读
2021年6月4日线上举行的美国临床肿瘤学会(ASCO)年会上,由山东大学齐鲁医院刘联教授团队发起的一项前瞻性II期单臂研究:卡瑞利珠单抗联合阿帕替尼以及S-1±奥沙利铂新辅助或转化治疗局部晚期cT4a/bN+胃癌,以壁报展示形式发布。裕策生物助力刘联教授团队,使用WES、RNA seq、TCR Seq等多组学平台探索了免疫+抗血管生成+化疗的新辅助治疗中获益人群的分子特征,评估肿瘤病理缓解率与相关生物标志物之间的关系,寻找筛选优势获益人群的生物标志物。
研究背景
世界卫生组织国际癌症研究机构(IARC)发布的2020年全球最新癌症负担数据显示,2020年中国新发癌症病例457万例,死亡病例300万例,其中胃癌新发病例47.8万例,死亡病例37.4万例,发病率和死亡率均排名第三位。中国胃癌五年生存率仅有30%,主要原因为相当部分胃癌患者确诊时已为晚期,其中相当数量的患者属于局部晚期,即肿瘤分期为cT4a/bN+,处于可手术和不可手术的临界状态,通常由手术医生评估后制定治疗方案。遗憾的是,对于这部分患者,即使开展手术,也很难实现根治性(R0)切除,难以为患者带来长期生存获益。
胃癌新辅助化疗获益有限:
如何通过优化围手术期策略来改善患者预后一直是临床专家努力的方向。临床上通常通过术前新辅助/转化治疗,实现肿瘤的降期,从而提高这部分患者的R0切除率,实现长期获益。目前胃癌围术期新辅助化疗主要有ECF、FLOT4等方案,比起单纯手术能为患者带来一定生存获益,但疗效仍然较为有限。
免疫联合疗法进军胃癌围手术期治疗:
随着代表性的CheckMate-649研究的成功,免疫检查点抑制剂联合化疗在胃癌的应用跻身一线。但目前新辅助治疗在化疗基础上联合免疫策略仍在探索阶段,一些正在开展的围手术期新辅助治疗研究,如:2020 ASCO公布的卡瑞利珠单抗联合FOLFOX作为可切除的局部晚期GC/GEJ的新辅助治疗结果显示,9%的患者达到病理完全缓解(pCR),73%的患者实现了肿瘤降期,且耐受性良好;2020 ESMO公布的NCT04341857研究则探索了信迪利单抗+FLOT新辅助治疗GC/GEJ的疗效,22.2%的患者达到pCR,影像学检查显示ORR达85.7%,DCR为100%;阿帕替尼联合SOX方案用于局部进展期胃癌新辅助治疗的G329研究结果显示,整体病理缓解率(pRR)达89.7%,手术R0切除率达96.6%。上述研究显示出了令人鼓舞的结果,提示我们,免疫联合化疗、抗血管生成联合化疗不失为可行的围手术期治疗方案。
山东大学齐鲁医院肿瘤内科主任刘联教授团队在前期研究的基础上,制定了免疫+抗血管生成+化疗的三联方案“卡瑞利珠单抗+阿帕替尼+S-1±奥沙利铂”的新辅助治疗方案,以期通过同时解除免疫抑制、重塑有利于肿瘤免疫的微环境、促进肿瘤细胞凋亡增加肿瘤特异性抗原的释放这三个方面入手,达到1+1+1>3的协同增效的作用。
研究设计
该研究纳入的T4a/bN+ 胃癌患者接受至少2个周期的卡瑞利珠单抗(200mg d1)联合阿帕替尼(250mg d1-14)以及 S-1 (50mg bid d1-10)±奥沙利铂(85 mg/m2 d1)的治疗,然后进行重新评估是否可以手术。并对围手术期的样本进行全外显子组测序(WES)、转录组测序(RNA seq)、T细胞受体测序(TCR seq)和肿瘤浸润免疫细胞的多平台多维度的综合分析。研究主要目的为了评估卡瑞利珠单抗与阿帕替尼±S1±奥沙利铂联合治疗新辅助可切除的局部晚期胃癌的病理缓解率(pCR)及无疾病复发生存期(RFS),以及评估肿瘤病理缓解率与相关生物标志物之间的关系。

研究方法示意图
研究结果
入组25位患者中位年龄63岁(48 ~ 70岁),其中男性患者19例;cT4aN2-3 患者11例,cT4bN2-3患者 14例。
三联疗法新辅助疗效理想:
在24例可评估的患者中,治疗的影像学反应率(RR)达33.3%(8/24),肿瘤降期率达79.2%(19/24)。在18例R0切除患者中,3例患者病理完全缓解(pCR),2例患者主要病理缓解(MPR,肿瘤残余活细胞≤10%),3例患者病理部分缓解(残留癌细胞11%-49%),病理缓解率为44.4%,病理显著缓解率(pCR和MPR)为27.8%。术后中位随访12.5个月,在17例R0切除的患者中,术后无复发率76.5%(13/17)。未观察到3级以及以上不良事件。
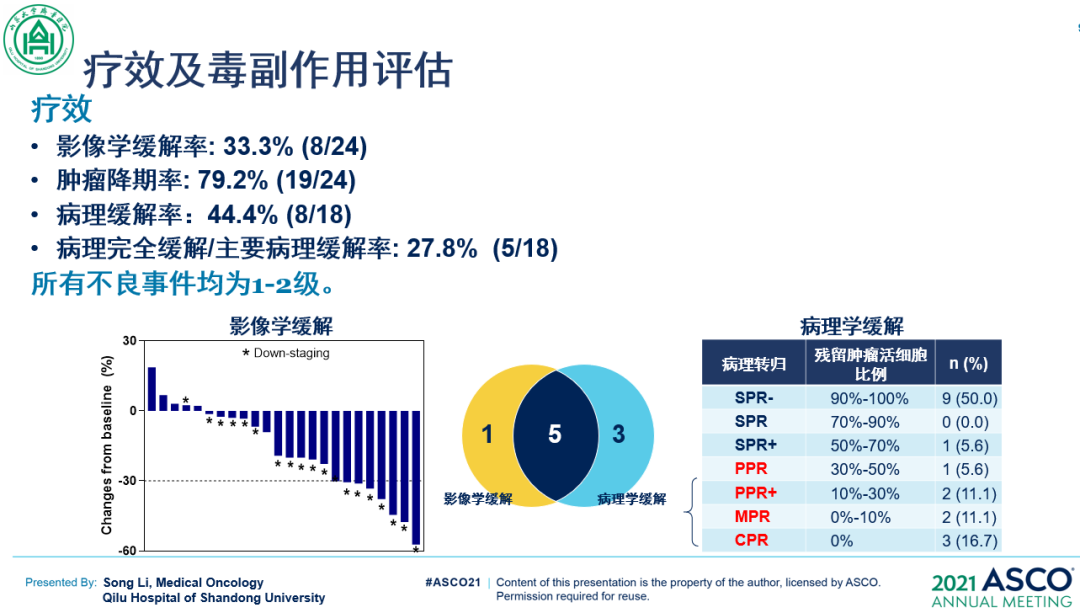
该研究结果疗效理想,安全性良好
结果显示,采用PD-1单抗、VEGFR-2小分子TKI和化疗三种策略的联合进行术前治疗局部晚期胃癌(包括T4a和部分T4b患者)无论从R0切除率、完全病理缓解率(pCR)、影像学缓解率(ORR)均取得了相对满意的疗效。同时,该方案也表现出较好的安全性。
这一联合治疗方案为局晚期胃癌的新辅助/转化治疗提供了新的思路和治疗策略,可帮助患者从很难手术转变为R0切除,部分患者从无法手术转化为可根治手术,最终转化为患者的生存获益,为未来的局部晚期胃癌患者临床治疗提供了很好的治疗选择。
疗效相关生物标志物的探索:
为探索肿瘤病理缓解与相关生物标志物之间的关系,该研究纳入了分子标志物研究,以期发现疗效预测或病情监测的biomarker。刘教授团队联合深圳裕策生物,应用全外显子组测序(WES)、转录组测序(RNA seq)、T细胞受体测序(TCR seq)和肿瘤浸润免疫细胞分析等多平台对围手术期的胃镜活检和手术切除的标本进行了多维度的综合分析。
结果显示,术前新辅助/转化治疗达到pCR和MPR的患者治疗前的标本中具有更高的免疫治疗优势标志物表达,如MSI-H、TMB-H、TNB-H和DNA损伤修复通路相关基因突变(BRCA2、PRKDC、ATM、POLD1、 POLE等)以及新的驱动突变(SSPO、TRPS1和DOCK2)和拷贝数变异(DUSP15缺失、FDFT1增加)

新辅助治疗前患者的基线分子特征,达pCR/MPR的患者的具有更高的免疫治疗优势标志物表达(MSI-H、TMB-H、TNB-H及富集有DDR通路突变)
这部分达pCR/MPR患者经新辅助治疗后的手术切除标本中,TMB/TNB等上述分子标志物表达水平大幅下降(图3A);TCR seq分析显示达pCR/MPR患者的肿瘤浸润T淋巴细胞的不同TCR克隆的丰度也发生了相应改变(图3B)。表明免疫治疗优势人群更能从卡瑞利珠单抗+阿帕替尼+S-1±奥沙利铂新辅助/转化治疗中获益。
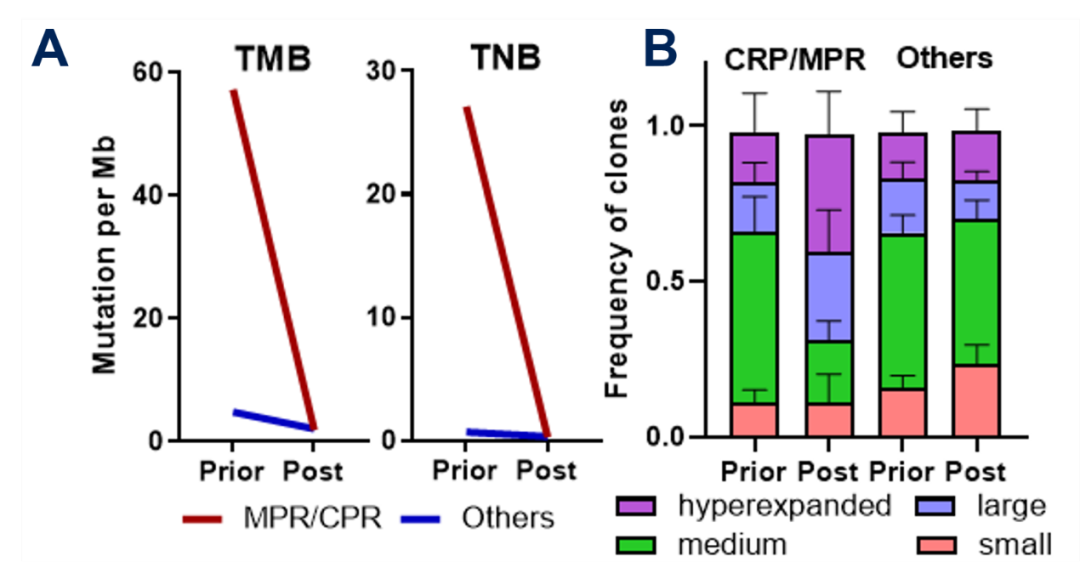
A.术后切除样本评估达pCR/MPR的患者中,其TMB和TNB水平较基线状态显著降低,而未达pCR/MPR的患者的TMB和TNB水平相对稳定;B. 达pCR/MPR患者中各种TCR克隆的频率较基线状态均发生了明显的改变;而未达pCR/MPR患者中各种TCR克隆的频率较基线状态基本没有发生改变。
对围手术期的胃镜活检和手术切除的标本的肿瘤浸润免疫细胞比较分析发现,经新辅助治疗后达pCR/MPR患者基线时的间充质干细胞(Mesenchymal stem cells)浸润水平较高,且显著高于未达pCR/MPR患者;并观察到术后切除标本中pCR/MPR患者基的间充质干细胞水平显著降低;而未达pCR/MPR患者基的充质干细胞水平显著升高。表明基线时肿瘤免疫微环境中的间充质干细胞浸润水平低的人群可能无法从卡瑞利珠单抗+阿帕替尼+S-1±奥沙利铂新辅助/转化治疗中获益。
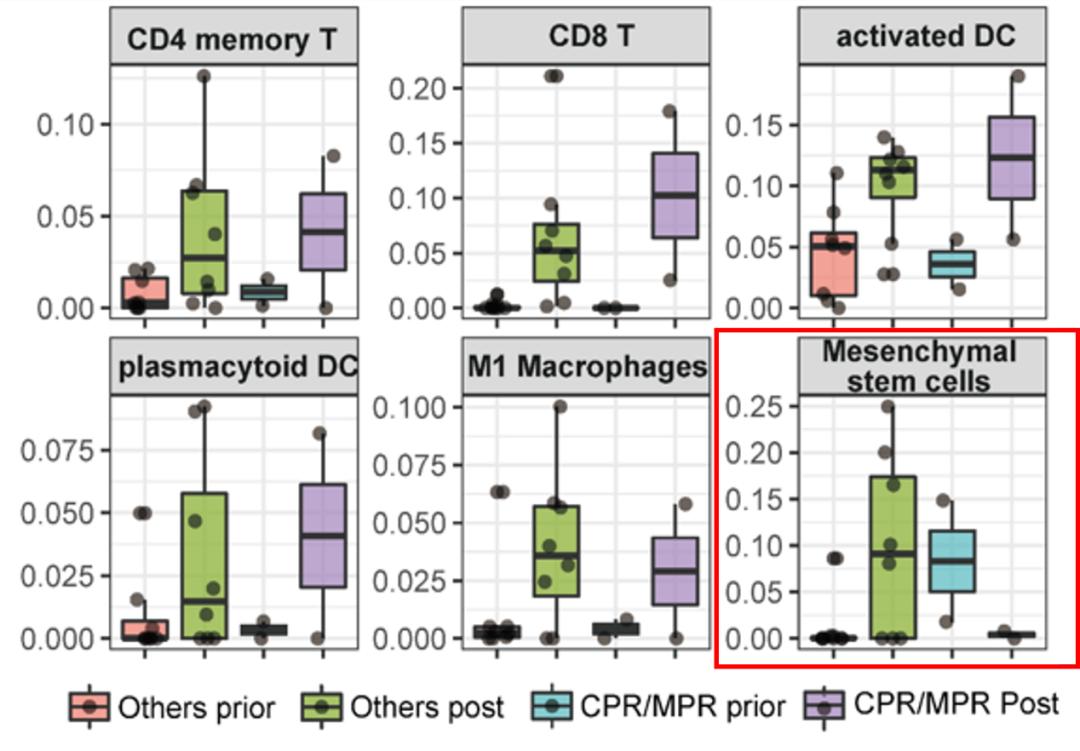
新辅助治疗前后,肿瘤微环境中相关免疫细胞浸润水平状态及动态变化
多组学多维度的综合分析结果提示MSI、TMB、TNB、间充质干细胞浸润水平这些指标可以用来筛选出新辅助联合治疗的优势获益人群,使得局部晚期胃癌术前治疗更加精准有效。
胃癌免疫治疗,未来已来
基于CheckMate-649的研究,FDA 于2021年4月批准纳武利尤单抗联合+化疗一线治疗晚期或转移性GC/GEJ;基于KEYNOTE-811研究的中期分析结果,2021年5月FDA加速批准帕博利珠单抗联合曲妥珠单抗和化疗一线治疗HER2阳性局部晚期不可切除或转移性GC/GEJ。2021年版CSCO胃癌诊疗指南与国际同步推荐了胃癌一线免疫治疗方案,胃癌免疫治疗已全面迈入一线治疗时代。相关研究不断前移,并向术后辅助治疗和新辅助治疗快速挺近。

2021年版CSCO胃癌诊疗指南推荐的免疫及其联合治疗方案
CheckMate-649研究证实了免疫联合化疗在PD-L1 CPS≥5人群中具有PFS和OS的双获益;KEYNOTE-062研究的亚组分析提示CPS≥10、MSI-H和TMB-H可能是免疫治疗单药治疗有效的生物标志物。胃癌的TCGA和ACRG等分子分型的研究显示胃癌是异质性很高的肿瘤,仅依靠传统的PD-L1状态可能无法准确地筛选从免疫治疗获益的患者人群,无法精准地预测治疗效果。目前,包括:肿瘤免疫微环境(TIME)、EB病毒感染、TMB、TNB、MSI、肿瘤浸润淋巴细胞(TIL)、ctDNA动态变化、DDR通路基因(POLE/POLD1、MUC16)等生物标志物研究也在积极开展中,如何探索新型生物标志物、组合多种生物标志物助力免疫单药以及联合治疗有效人群的筛选,实现精准的个体化治疗已成为临床实践中亟待解决的问题。
裕策生物开发的YuceOne® Plus系列产品,可全面覆盖胃癌免疫治疗相关的生物标志物,其中基于独有的TruNeoTM 新生抗原预测算法,在TNB指标的评估上居于国际领先水平,在临床实践中能够更加准确地筛选出免疫治疗优势获益的人群。
此外,在肿瘤免疫微环境的预测生物标志物探索层面上,裕策的RNA GEP、mIHC、DSP平台已经在一些临床研究和临床试验中得到了验证,为新的预测性生物标志物的开发积累了大量数据。
小结
免疫治疗突破了胃癌化疗和靶向治疗生存期有限的瓶颈,已从晚期患者的后线治疗逐渐发展到一线及围手术期的治疗。随着研究数据的积累,进展期胃癌的新辅助治疗展现出了良好的治疗前景,未来对于化疗、靶向治疗、免疫治疗之间的不同组合还有更多相关临床研究需要开展,最终提升临床治疗效果。如何更为精准地筛选出优势获益人群,预测性生物标志物的发现及遵循有效的预测性生物标志物的方案选择是关键。
Copyright©2021
深圳裕策生物科技有限公司 版权所有
粤ICP备16128839号

