随着HRD逐步发展成为新型生物标志物并用于肿瘤精准治疗,HRD临床检测也日益受到重视。由中国抗癌协会肿瘤标志专业委员会遗传性肿瘤标志物协作组、中华医学会病理学分会分子病理学组组织及行业知名专家共同参与撰写的《同源重组修复缺陷临床检测与应用专家共识》于近日在《中国癌症防治杂志》正式发布。

该共识围绕HRD定义描述、HRD的临床应用、HRD临床检测规范化、HRD临床检测和应用的问题与展望,结合国内外应用现状,为临床提供7条HRD临床检测与应用专家共识,旨在提高临床医师及检测等相关人员对HRD临床意义及检测规范的认识,从而更加准确合理地开展HRD检测及结果解读,为患者提供更优质的临床服务。以下为关于HRD临床检测与应用的7条共识总结,详细共识可点击文末阅读原文。
01 HRD定义描述
HRD通常指细胞水平的HRR障碍状态,HRD会产生可量化的、稳定的基因组改变,目前主要通过LOH、TAI和LST3个指标的综合检测得出GIS,临床实践中以BRCA1/2基因致病性突变与GIS评估肿瘤HRD状态。鉴于HRR通路以及细胞信号通路的复杂性,通过临床检测方法实现肿瘤细胞HRD全面而准确的评估仍具挑战。
02 HRD肿瘤临床病理及分子特征
HRD是恶性肿瘤较为常见的分子标记,卵巢癌、乳腺癌、前列腺癌、胰腺癌发生率较高;HRD阳性卵巢癌、乳腺癌表现出一定的临床病理学特征,BRCA相关的遗传性乳腺癌和卵巢癌表现更显著。HRD是较稳定的恶性肿瘤分子标记,其评估通常不受肿瘤取材部位(同一部位不同病灶或原发和转移病灶)影响。
03 HRD临床检测的应用价值
HRD临床检测在PARP抑制剂治疗晚期卵巢癌疗效预测中具有重要的应用价值,可对卵巢癌患者进行分层,优化相应治疗决策,最大限度扩大PARP抑制剂临床获益人群;在乳腺癌、胰腺癌、前列腺癌中,其对PARP抑制剂或含铂类药物的临床应用可能也具有潜在的指导价值,相关研究尚在探索中。另外,我国尚无获批的HRD检测试剂,临床实施检测时应依据患者肿瘤类型、分期与诊疗史,并在患者充分知情同意前提下,选择与适应证和(或)拟应用的PARP抑制剂种类最匹配且经严格性能验证的商业试剂盒。
04 HRD临床检测规范化
HRD检测优先选择3年以内的石蜡包埋肿瘤组织,并观察肿瘤细胞的含量和数量,以保证有足够的肿瘤细胞用于检测;若含量不足,应进行富集,尽可能避免出血和坏死区域。新鲜组织不推荐作为常规检测样本类型,若使用需先评估其肿瘤细胞含量。建议提供患者配对外周血作为非肿瘤对照样本,这有助于了解胚系BRCA1/2以及其
他HRR相关基因突变情况。
05 检测技术选择与确认
基于SNPs的“基因组瘢痕”分析是当前最具应用前景的HRD临床检测方法,能从BRCA野生型肿瘤患者中有效筛选出PARP抑制剂治疗的潜在获益人群。当前亟待推进我国相应合规试剂盒的开发与验证工作,其SNPs位点选择与Panel设计应着重把握我国人群的分子遗传学特征,并积极倡导联合开展PARP抑制剂前瞻性多中心临床研究验证。
06 HRD算法的标准化及精准化
在HRD临床检测中,基于SNPs位点信息进行HRD评分计算的准确度主要依赖于对SCNV的准确分析;同时,通过WGS、WES等检测技术获取更多的基因组信息,有助于进一步提升HRD评分计算的准确度;应用人工智能技术辅助分析HRD的多维度特征,已展示出高效识别HRD阳性人群的潜在优势。必须强调的是,任何一种检测方法、评分计算方法和判断标准在临床正式应用前,都需要经过严格的性能分析与临床效能验证。
07 HRD报告建议
HRD临床检测报告内容除重点描述BRCA1/2等HRR相关基因变异情况以及GIS计算数值外,还应针对相应癌种的PARP抑制剂疗效预测价值进行解读;HRD评分阈值判定与不同癌种、不同PARP抑制剂及其相应适应证有关。同时,目前尚缺乏HRD评分应用于中国人群PARP抑制剂疗效预测的大样本临床研究数据,报告应着重阐述其检测的局限性。
目前,全球已有多种PARP抑制剂获批上市,如由FDA批准的奥拉帕利(Olaparib),鲁卡帕利(Rucaparib),尼拉帕利(Niraparib),他拉唑帕利(Talazoparib)以及国内NMPA批准的氟唑帕利(Fluzoparib)和帕米帕利(Pamiparib),已相继在卵巢癌、前列腺癌、乳腺癌、胰腺癌等诸多适应症中获批。HRD临床检测作为PARP抑制剂重要的疗效预测标志物,共识明确指出,基于SNPs的“基因组瘢痕”分析是当前最具应用前景的HRD临床检测方法,能从BRCA野生型肿瘤患者中有效筛选出PARP抑制剂治疗的潜在获益人群。当前亟待推进我国相应合规试剂盒的开发与验证工作,要求其SNPs位点选择与Panel设计应着重把握我国人群的分子遗传学特征(SNPs位点的选择应注意把握2个要点:一是位点的分布需相对均匀;二是需要尽可能地覆盖更多的杂合位点),并积极倡导联合开展PARP抑制剂前瞻性多中心临床研究验证。截至目前,全球范围内仅有2款HRD检测产品获批,国内尚无NMPA批准的HRD检测产品。
裕策生物HRD检测产品-馥裕康加强版,根据中国人群基因组多态性,采用高分辨SNP骨架探针捕获方式,包含可有效覆盖整个基因组的>5.2万个SNP位点,以约50Kb间隔均匀覆盖人整个基因组,全方位精准评估LOH,TAI,LST基因组不稳定性指标,综合BRCA1/2突变情况全面评估HRD状态。通过肿瘤纯度和倍型校正,对HRD算法进行优化,开发出更适用于中国患者的评分体系。该产品经过上百例样本充分测试分析,HRD标准品检验、WGS一致性对比分析,在BRCA突变阴性患者中可进一步有效筛选出约25%PARP抑制剂潜在获益人群,助力更多肿瘤患者从PARP抑制剂和铂类化疗中获益。
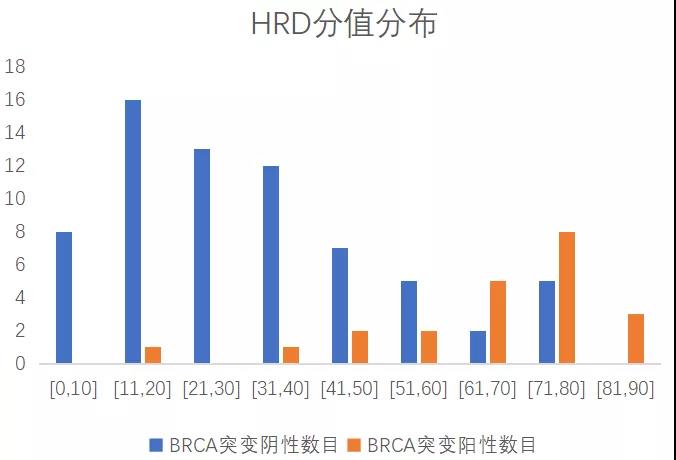
裕策内部上百例测试数据显示,HRD score分值与BRCA突变结果呈双峰分布
HRD score检测提高约25% BRCA阴性PARPi获益人群
此外,该产品同时覆盖上百个靶向和化疗用药相关基因,数十个同源重组修复(HRR)基因和遗传性肿瘤相关基因,全面评估靶向及化疗药物疗效/毒副风险,遗传性肿瘤易感风险提示,帮助临床医生为患者制定个体化的治疗方案。
除了馥裕康加强版产品之外,裕策生物针对PARP抑制剂伴随检测搭建了相对完善的产品体系,包括BRCA1/2全外显子基因检测,HRR基因突变检测,以及针对不同适用人群的Panel套餐,为肿瘤患者提供临床用药一站式解决方案,力争为患者提供更优质的临床服务。
Copyright©2021
深圳裕策生物科技有限公司 版权所有
粤ICP备16128839号

