免疫检查点抑制剂上市以来,明显改善了癌症的治疗策略,阻断PD1/PD-L1信号通路可逆转免疫抑制肿瘤微环境,增强机体内源性的抗肿瘤免疫效应。但大多数晚期非小细胞肺癌(NSCLC)患者对PD-1/PD-L1单药治疗依然存在反应率偏低和原发/继发性耐药等问题。研究表明低剂量地西他滨能增加CD4+、CD8+、IFNγ+T 细胞浸润和拓宽T细胞抗原受体库。低剂量地西他滨联合PD-1抑制剂已经证实在复发/难治性霍奇金淋巴瘤中具有逆转PD-1抑制剂的耐药及提高PD-1抑制剂的效能的作用。那低剂量地西他滨与PD-1/PD-L1抑制剂联合应用于实体肿瘤中,会不会展现更强的抗肿瘤活性呢?
最近,中国人民解放军总医院生物治疗科韩为东教授团队在Frontier in Oncology (IF 4.848)发表了一篇名为 Case Report: Low-Dose Decitabine Plus Anti-PD-1 Inhibitor Camrelizumab for Previously Treated Advanced Metastatic Non-Small Cell Lung Cancer 的文章,报道了低剂量地西他滨联合卡瑞利珠单抗治疗3例晚期转移性经治NSCLC患者的临床数据,揭示低剂量的地西他滨可以增敏PD-1抑制剂的效能,证明表观遗传调控药物在晚期NSCLC中具有调节PD-1抑制剂反应的潜力。裕策生物参与其中的基因检测与数据分析工作。

图1:刊登文章 title page
总体而言,3例晚期转移性NSCLC患者均为一线治疗后进展,这3例患者重新穿刺活检组织的NGS分析显示均具有肿瘤突变负荷(TMB)低,肿瘤新生抗原负荷(TNB)低,微卫星稳定(MSS),HLA杂合性缺失阳性(HLA LOH)的特征,这些特征目前均被认为是影响PD-1/PD-L1抑制剂疗效的不利因素。这三名患者都对低剂量地西他滨联合卡瑞利珠单抗有响应,不良反应在可控范围之内,这表明低剂量地西他滨可以增敏PD-1/PD-L1抑制剂。

图2:三位患者的治疗过程
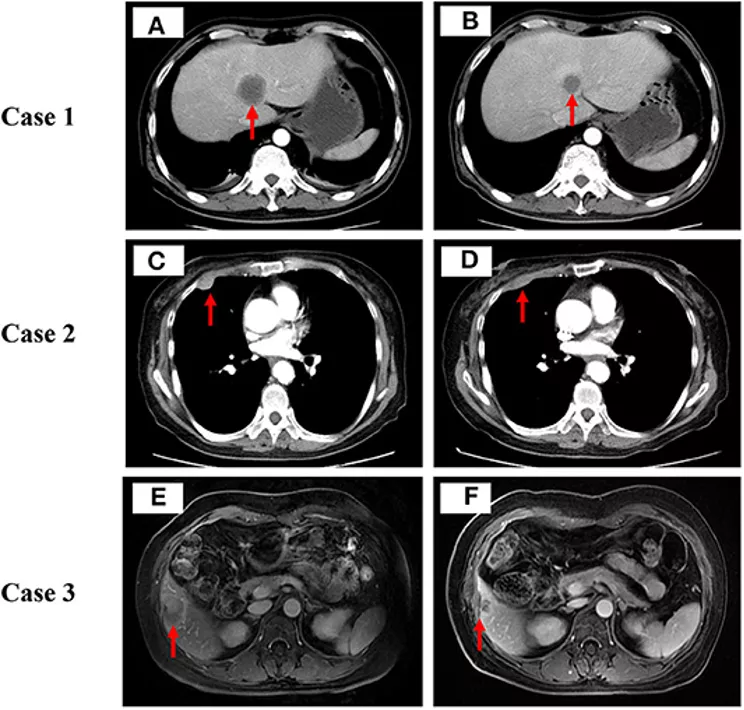
图3:3例患者在低剂量地西他滨联合卡瑞利珠单抗治疗前后病灶的CT/MRI表现,肿瘤病变用红色箭头表示
案例详细描述
案例1
男性,47岁,无吸烟史,因刺激性咳嗽起病。胸部CT显示右肺肿块伴纵隔淋巴结和右肺门淋巴结多发转移,右肺肿块穿刺活检病理诊断为未分化腺癌,活检标本的基因检测显示EGFR和ALK阴性。该患者于2016年11月确诊为IV期肺腺癌后接受了6个周期的一线贝伐珠单抗联合培美曲塞和顺铂化疗和质子放射治疗。2017年8月,CT检查显示双侧锁骨上淋巴结、左侧腋窝淋巴结、腹膜后淋巴结、双侧肾上腺、骨骼和肝脏出现多个新发转移病灶,其中肝脏靶病灶病变最大(图3A)。右锁骨上转移淋巴结重新活检病理显示低分化腺癌浸润,分子结果阴性。肿瘤组织外显子测序结果显示,TMB和TNB分别为7.83 Muts/Mb和3.72 Neos/Mb,MSI-low , HLA LOH阳性,PD-L1表达为阳性(+5%)。
2017年9月起,该患者接受低剂量地西他滨(10mg/天,第1至5天)联合卡瑞利珠单抗(200mg,第6天),治疗6个周期,每3周为一个周期。治疗后患者刺激性咳嗽明显减轻,2个周期后复查CT显示双侧肾上腺和肝脏的转移病灶显著缩小(图3B)。6个周期后患者出现新发的NSCLC转移,遂终止低剂量地西他滨联合卡瑞利珠单抗治疗。新发病灶穿刺活检组织分析显示TMB从7.83下降到0.1Muts/Mb,TNB从3.72下降到0.03Neos/Mb,MSI-low状态和HLA LOH阳性在治疗过程中保持不变。治疗过程中出现的不良反应事件包括3级贫血(血清血红蛋白:70g/L)和2级恶心(CTCAE 4.0版)。病情进展后,患者转入临终关怀治疗,于2018年4月因肺部感染死亡。
案例2
女性,74岁,无吸烟史,因右下胸壁疼痛起病。CT发现右肺多发结节伴纵隔淋巴结、肝、胸膜转移,右肺肿块病理提示肺腺癌。基因检测结果显示EGFR L858R和EGFR T790M突变,其余常见驱动基因突变为阴性。2016年4月诊断为IV期肺腺癌后,患者先使用吉非替尼治疗7个月,耐药后改用奥西替尼,1个月后复查疾病稳定,3个月后复查疾病进展。改行培美曲塞单药化疗2个周期,但由于胃肠道反应重患者不能耐受而停止治疗。此外患者还接受了肝脏微波消融术。2017年9月,CT扫描显示肺和胸膜结节增大(图3C)。胸膜转移灶活检后外显子测序结果显示TMB低(2.49Muts/Mb),TNB低(1.55Neos/Mb),MSI-low,HLA LOH阳性。该患者接受7个周期低剂量地西他滨(10mg/天,第1至5天)联合卡瑞利珠单抗(200mg,第6天)治疗,2个周期后复查CT显示,纵隔淋巴结、肝脏和胸膜结节转移明显缩小(图3D),右下胸壁疼痛也明显改善。7个周期后肿瘤出现疾病进展,TMB从2.49增加到2.98Muts/Mb,TNB从1.55下降到1.32Neos/Mb,MSI-low状态和HLA LOH阳性保持不变。药物相关不良反应在可耐受范围内。患者于2019年5月因多器官功能衰竭死亡。
案例3
女性,46岁,无吸烟史,因干咳而起病。胸部CT显示左上肺肿块伴纵隔淋巴结、肝、骨转移。支气管镜活检肿瘤组织病理显示左上叶浸润性肺腺癌。基因检测未发现EGFR或ALK的阳性突变或重排,2015年10月诊断为IV型肺腺癌后,该患者接受了6个周期的贝伐珠单抗联合培美曲塞和顺铂和12周期的贝伐珠单抗联合培美曲塞维持治疗,并行肝转移灶TACE治疗。2017年4月,CT显示肝脏转移性病变明显增多图3E),穿刺活检肝转移灶进行基因检测显示驱动基因阴性,TMB低(1.91Muts/Mb),TNB低(0.75 Neos/Mb),MSI-low,HLA LOH阳性, PD-L1表达为阳性(+10%)。该患者共接受8个周期的低剂量地西他滨联合卡瑞利珠单抗治疗。2个周期后复查腹部MRI显示肝转移灶明显缩小(图3F),患者的干咳也明显改善。8个周期的治疗后患者肿瘤病情再次出现进展,再次穿刺活检结果显示TMB从1.91下降到1.16Muts/Mb,TNB从0.75下降到0.45Neos/Mb,MSI-low状态和HLA LOH阳性保持不变,出现ALK基因突变,患者遂进行开始口服克唑替尼靶向治疗,效果好。
小结
这篇文章报道了3例末次治疗无效,具有免疫治疗不利因素(TMB低、TNB低、MSI低、HLA-LOH阳性)的晚期NSCLC患者,在接受低剂量地西他滨联合PD-1抑制剂治疗后均获得临床响应。数据显示表观遗传调控药物可以增敏PD-1抑制剂,为晚期NSCLC的治疗提供了新的思路。
专家点评
解放军总医院生物治疗科首创的表观免疫疗法率先在复发难治性霍奇金淋巴瘤取得了突出的疗效,该疗法也在晚期实体肿瘤中进行了积极的探索。
本文中报道了表观免疫疗法在化疗或靶向治疗失败的转移性非小细胞肺癌中的研究结果,3例患者的biomarkers均不利于单药PD-1抑制剂,如PD-L1低表达或阴性,TMB/TNB低和HLA-LOH阳性等,然而表观免疫疗法在这3例患者中均获得了临床响应,提示表观遗传调控药物可以增敏PD-1抑制剂,为晚期NSCLC的治疗提供了新的思路。然而,对于一个全新的组合方案,预测性biomarkers 也应该与单药PD-1抑制剂不一样,不应止于肿瘤的突变率、PD-L1表达等,所以有必要对这一新的疗法从肿瘤生物学角度进行分析,预判什么样的肿瘤转录组特征或者突变特征会对这种去化疗的新组合产生响应性?前瞻性指标的鉴定对阐明疗法的选择性以及特殊性是有帮助的,是指导选择精准免疫治疗,或者表观免疫治疗疗效预判必要的伴随检测指标。
专家介绍
韩为东
解放军总医院生物治疗科主任、教授
临床肿瘤学博士研究生导师
国家百千万人才
首都科技创新领军人才
原总后勤部科技新星
重点研究方向
主要从事肿瘤治疗抵抗机制与肿瘤免疫治疗的临床研究。
先后承担科技部重大专项1项,973课题2项、863项目3项、国家自然基金重大项目1项,重点项目2项,面上项目7项,
北京市生物技术前沿项目1项,获得企业投资3项,4项临床治疗技术企业转让。国家发明专利20余项。主编专著3部。
论文研究方向
以第一作者或通讯作者发表SCI论文160余篇,累计影响因子740余分。参与获得省部级二等奖以上4项。
2015年,成立了中国研究型医院生物治疗学专业委员会(二级学会),并担任首届主任委员。
丰恺超
中国人民解放军总医院生物治疗科
教 授
北京医学奖励基金会肺癌医学青年专家委员会委员
擅长常见肿瘤的免疫治疗、靶向治疗、I/II期临床试验
重点研究方向
免疫检查点抑制剂治疗晚期恶性肿瘤
嵌合抗原受体(CAR)T细胞治疗晚期实体肿瘤及恶性血液肿瘤
表观遗传学药物逆转免疫检查点抑制剂耐药及增敏增效的研究
论文发表情况
已发表SCI论文10余篇,其中以第一作者发表6篇,发表于Clin Cancer Res、J Hematol Oncol、Protein& Cell、Cellular & Molecular Immunology等期刊,影响因子>30
参考文献:
1.Yan X, Zhao Y, Liu Y, Yang Q, Dong L, Wu Z, Nie J, Chen D, Bai M, Ti D, Feng K and Han W (2020) Case Report: Low-Dose Decitabine Plus Anti-PD-1 Inhibitor Camrelizumab for Previously Treated Advanced Metastatic Non-Small Cell Lung Cancer. Front. Oncol. 10:558572. doi: 10.3389/fonc.2020.558572
Copyright©2021
深圳裕策生物科技有限公司 版权所有
粤ICP备16128839号

