2020年11月9日,美国病理学家协会(CAP,College of American Pathologists)公布了2020上半年CAP-PT(Proficiency Testing,PT)的“CFDNA-A”项目能力验证评估报告。裕策生物旗下深圳裕康医学检验实验室(以下简称:裕康医学实验室)的检测结果与预期结果100%一致,裕策生物以满分的优异成绩通过CAP-CFDNA室间质评。

CFDNA项目是CAP于2018年新开展的,针对全球范围的基因检测实验室,基于液体活检技术检测基因变异能力的测评项目。该项目包含3个样本,涉及 BRAF / EGFR / KRAS / IDH1 / NRAS 基因的多个检测位点,根据各实验室报告的该变异的LOD(检测限)值进行评估。
裕康医学实验室本次PT结果与CAP公布的标准结果完全一致,如下图所示:
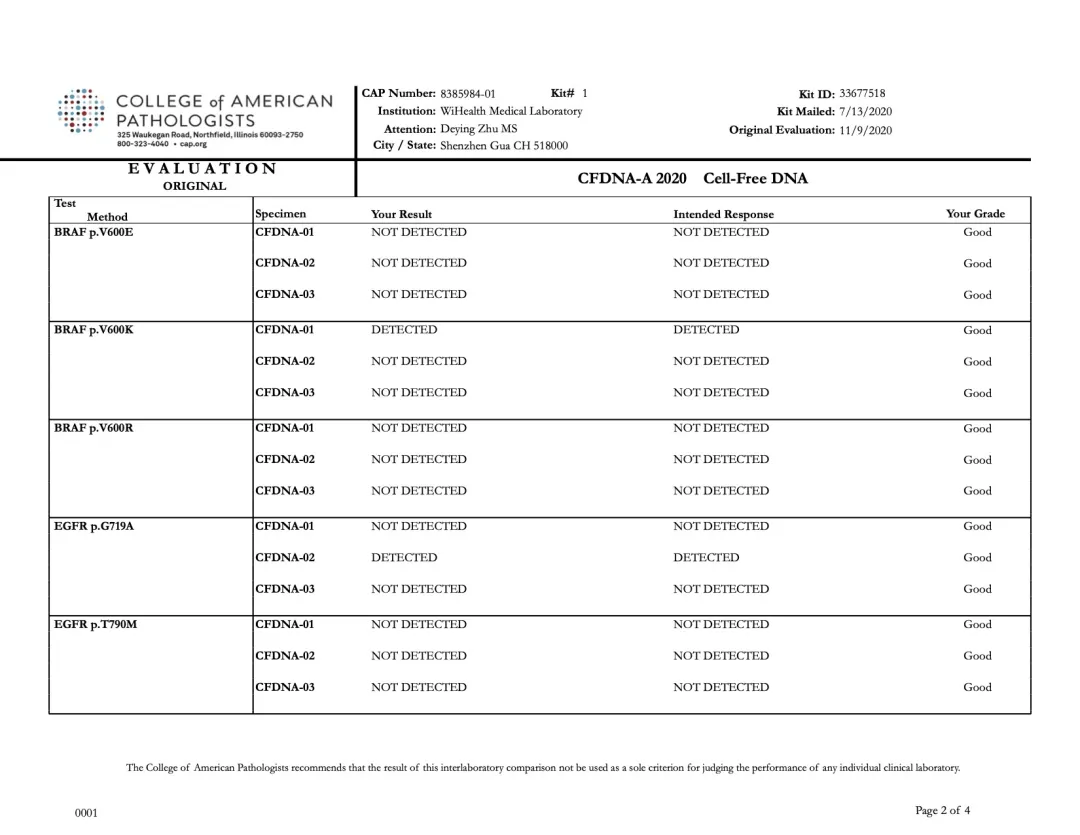
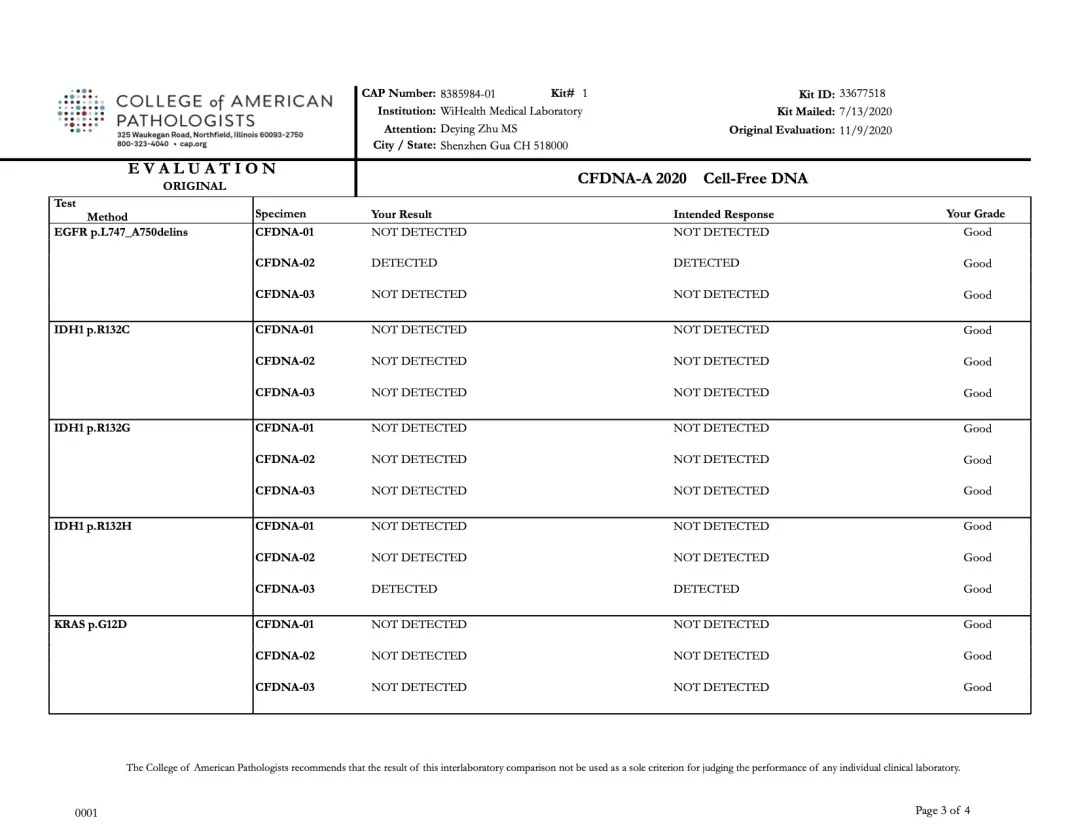
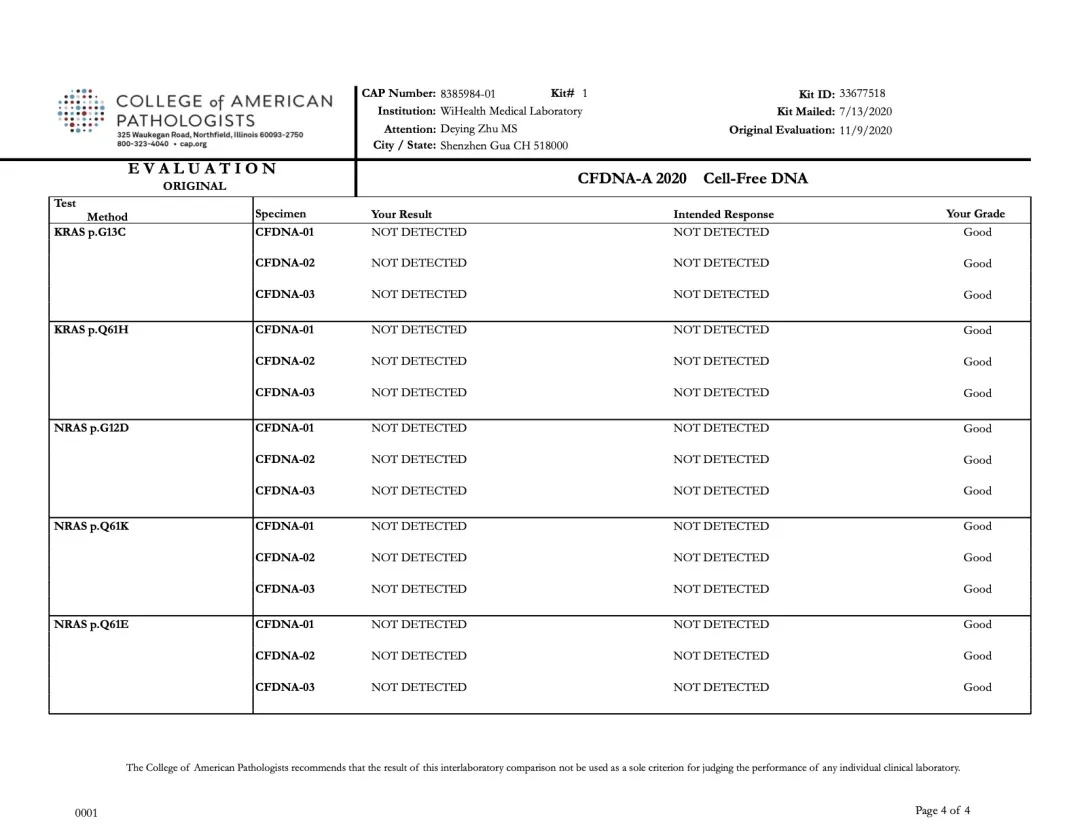
裕策生物“CFDNA-A” 项目检测结果
这是裕策生物继通过国家卫生健康委临床检验中心(NCCL)、欧洲分子基因诊断质量联盟(EMQN)、美国病理学家协会(CAP)多项质量评价后的又一佳绩!此次满分通过CAP能力验证计划,再次证明了裕策生物拥有过硬的技术实力、严谨的操作流程、卓越的产品设计。同时,也标志着裕康医学实验室已经跻身国际一流的医学检验实验室行列,实验室质量管理体系、实验技术水平、信息分析等各方面的规范性和准确性均得到国际认证!
未来,裕策生物将一如既往地保持国际一流水准,以更严格标准要求自身,继续积极参加国内及国际上各类质评考核,再接再厉、不断开拓,为医生和患者提供高质量的产品和专业的服务!
关于美国病理学会
美国病理学家协会(College of American Pathologists,CAP)是世界最大的病理学家组织,成立于1947年,被认为是国际上最具权威的临床检测实验室认可机构之一,也是被证明了的一种有效的同行评估模式,堪称为行业的国际“黄金标准”,FDA明确要求必须是来自CAP认证的实验室实验数据。CAP的一个重要内容就是向世界各地参与的实验室开展能力验证活动(Proficiency Testing,PT也称为室间质评)。
关于裕康医学实验室
裕康医学实验室占地1500平方米,是以临床需求为中心、以肿瘤精准免疫检测为特色、以精准用药为导向的综合检测中心。裕康医学实验室已经通过广东省临床检验中心临床基因扩增检验实验室技术审核,按照美国病理学家协会(CAP)及ISO9001质量管理体系建设并持续完善实验室质量管理体系,在生产中使用被严格验证过的SOP(标准操作流程),其中设立了包含从组织病理检测到报告解读全流程数十项质控点,保障每一份临床样本检测的准确性。目前,裕康医学实验室已经通过欧洲分子基因诊断质量联盟(EMQN)和国家卫生部临检中心组织的多项室间质评项目,充分证明裕康医学实验室的检测水平达到了国际一流水准,展现了其作为精准医疗行业领先企业的技术实力和完善的质量体系。
裕策生物近期获得的质量认证
2019年7月 通过CAP-NGSST室间质评
2019年10月 通过德国莱茵TUV权威认证机构测评
2019年10月 通过NCCL室间质评
2019年10月 通过CAP-EGFR室间质评
2019年11月 通过EMQN室间质评
2020年1月 通过CAP-NGSST室间质评
2020年3月 通过EMQN室间质评
2020年5月 通过5项NCCL室间质评
2020年8月 通过CAP-MTP室间质评
2020年8月 通过NCCL室间质评
2020年8月 通过NCCL室间质评
2020年9月 通过CAP-NGSST室间质评
Copyright©2021
深圳裕策生物科技有限公司 版权所有
粤ICP备16128839号

