拨开迷雾:TESLA在cell发布新生抗原预测算法模型和核心参数
2020-12-16
【 返回列表 】
肿瘤发生发展过程会产生许多基因突变,这些突变后的片段在转录和翻译后形成的正常组织和细胞中所没有的多肽段被称为neoantigen(新生抗原)。当新生抗原被HLA I类分子呈递到肿瘤细胞表面后就可能引发免疫系统的抗肿瘤反应,由于新生抗原的特异性,一般不会引起机体出现免疫耐受以及自身免疫反应 ,因此它被研究人员认为是极具潜力的肿瘤治疗靶点。2017年的一项来自Nature的研究曾经报道[1],在人体内,新生抗原疫苗可以诱导特异性的抗肿瘤T细胞产生,并导致患者体内黑色素瘤的大幅度消退,并且针对非突变多肽很少产生免疫脱靶反应。
然而,从有限的样本中精确预测新生抗原的免疫原性仍面临着挑战。许多鉴别治疗相关新生抗原的方法结合了肿瘤测序与生物信息学算法,从而推断出肿瘤表位免疫原性的规律。但是,鉴于肿瘤细胞的突变具有复杂性和个体化的特征,所得出的结果很容易受到样本自身偏差的影响。此外,新生抗原免疫原性的预测还会受到肿瘤种类、病灶部位、人种等因素的影响。从肿瘤新生抗原免疫疗法开发所需的规模和通量来看,这可能并不是一个科研机构或者一个生物公司可以全部完成的。

在此背景下,为了全面、无偏差地分析肿瘤表位免疫原性的关键参数,加速这一领域的迅速发展,美国国家癌症中心(CRI)和帕克癌症免疫治疗研究所(PICI)联合纪念斯隆凯特琳癌症中心(MSKCC)、MD 安德森癌症中心等36家新生抗原研究机构成立了国际新生抗原筛查联盟(Tumor Epitope SeLection Alliance,简称:TESLA),该联盟旨在建立全球新生抗原检测的算法和标准。裕策生物作为国内第一家联盟成员,协力联盟建立更精准的抗癌靶点预测体系,推进肿瘤个体化免疫治疗的研究和应用。近日,肿瘤新生抗原筛选联盟的科学家们的最新研究成果发表于Cell ,该研究成果发现了可以更好地预测哪些新生抗原可以激活治疗癌症作用的算法模型和核心参数,这无疑将催生新一代更有效、更个性化的癌症免疫疗法,也代表着基于新生抗原的个体化免疫疗法新时代已经到来!
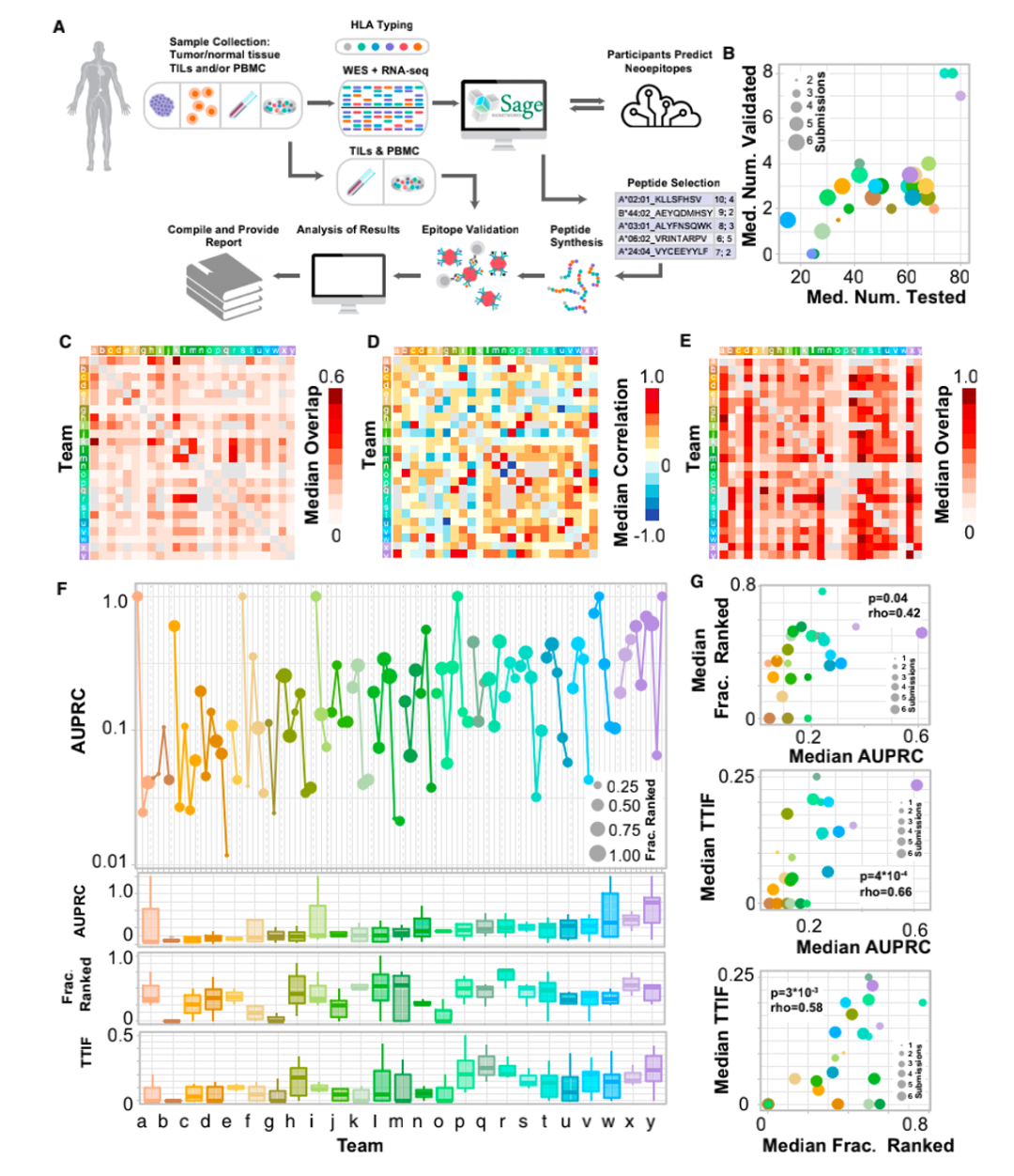
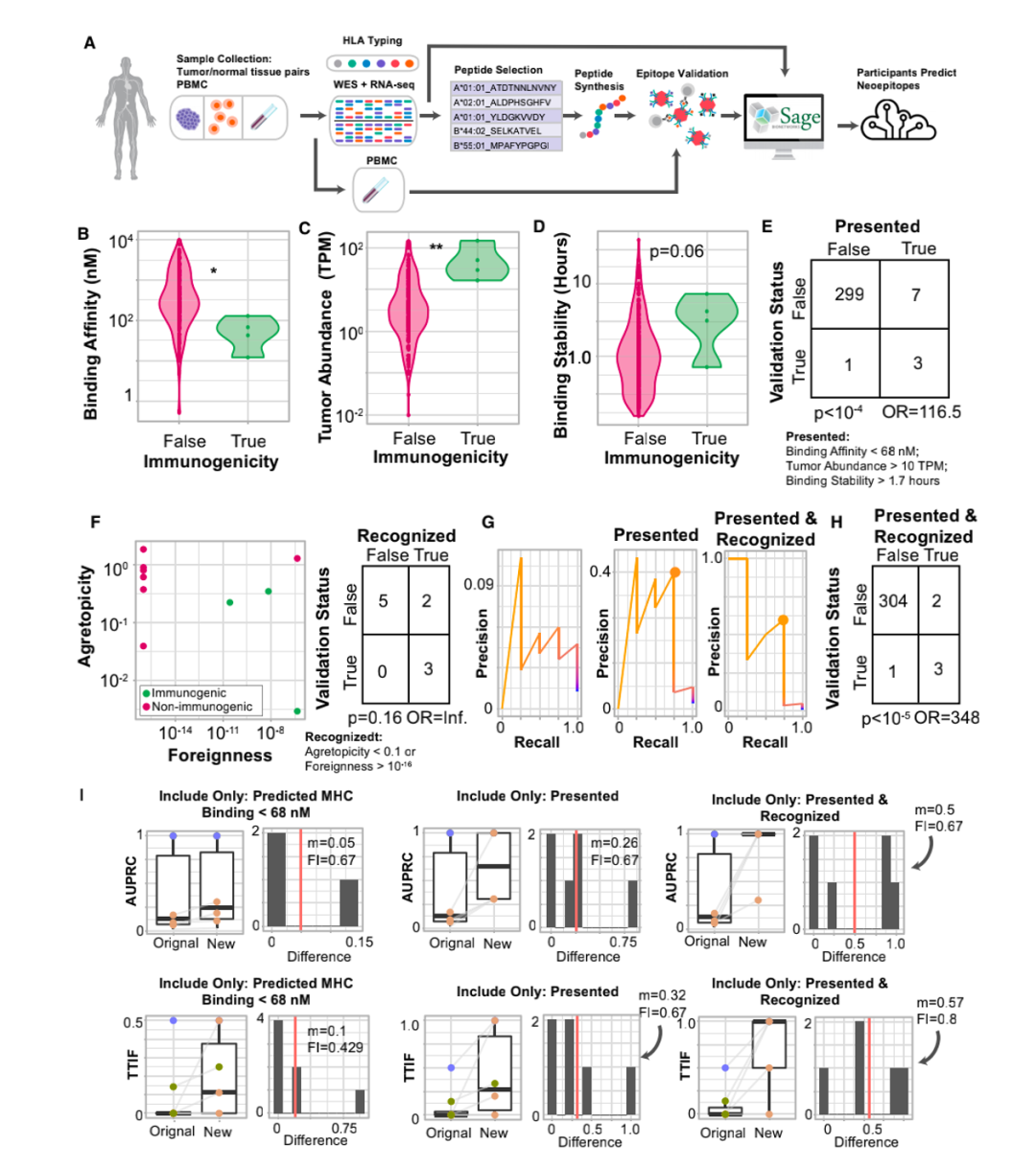
该研究使用了TESLA联盟的6对试者样本(3个转移性黑色素瘤患者和3个非小细胞肺癌患者)。具体其流程为:1.TESLA向每个团队提供相同的个体肿瘤外显子组测序(WES),RNAseq测序和临床HLA分型数据;
2.各个团队利用该数据分别预测新生抗原表位,并对新生抗原表位与相关MHC I的结合及引发免疫反应能力排序;
3.对预测中高排位的多肽(pMHC)做体外结合测试和多肽免疫反应测试。通过这一流程TESLA团队成员能够相应的优化他们的预测算法。
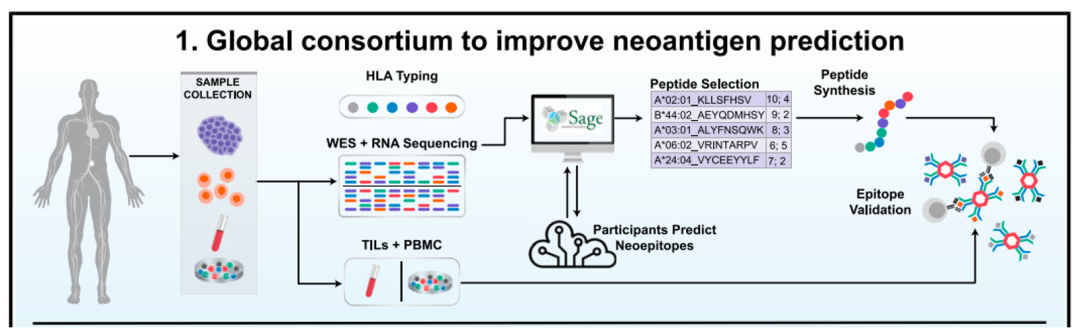
新生抗原预测流程
最终,研究人员对其中排名较高的608个多肽通过基于pMHC多聚体的检测方法检测免疫原性,结果显示只有37个(6%)具有免疫原性。分析每组TESLA团队前100名pMHC的重叠部分,发现大多数情况下,团队之间的重叠很少(少于20%),重叠的中位值如图1C所示。但是,分析排名前100的pMHC与另一个团队的整个列表之间的重叠(图1E),重叠的中位数要大得多(32%),这表明TESLA参与者在预测中产生差异的部分原因是表位过滤和排名的差异。图1
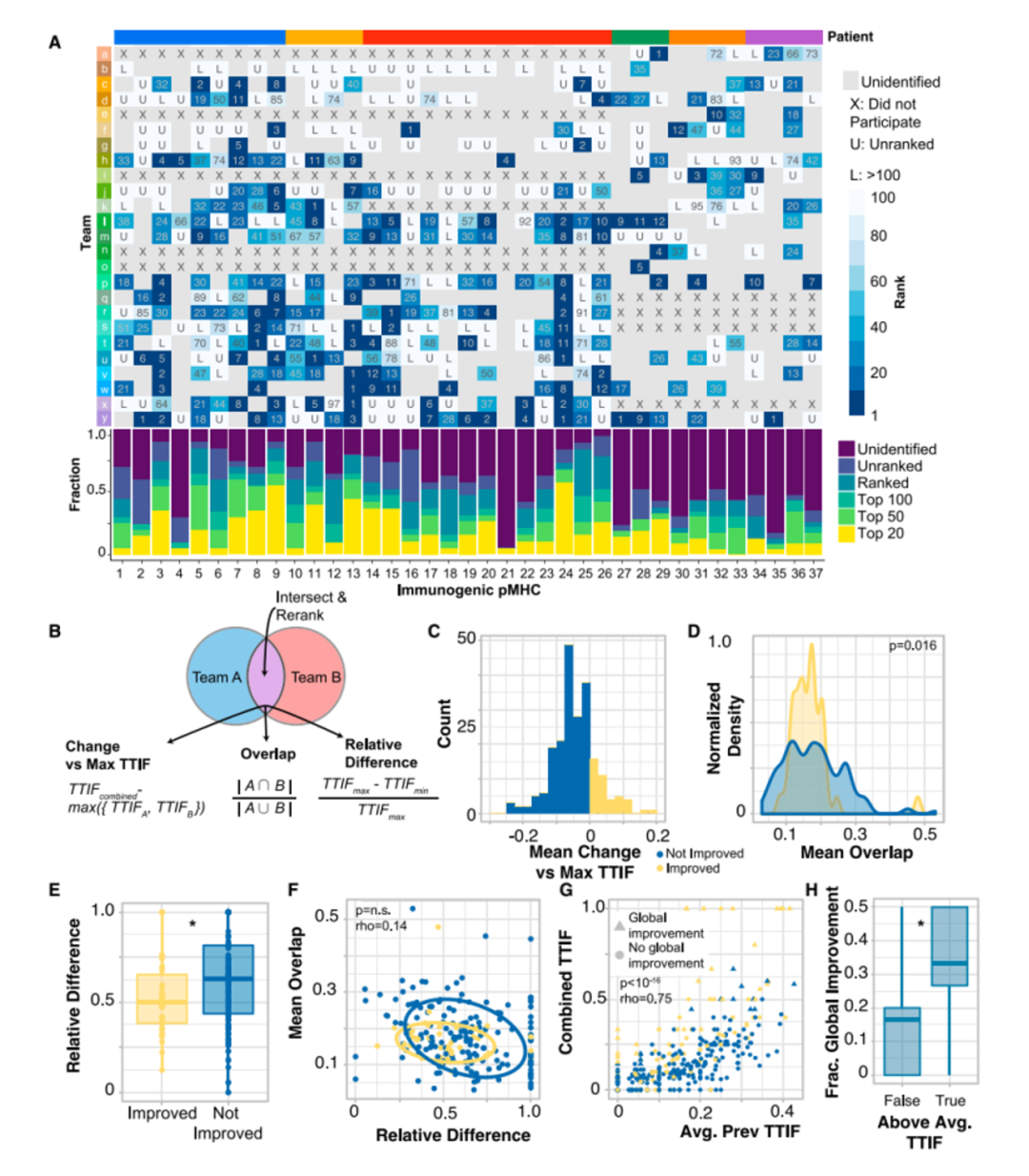
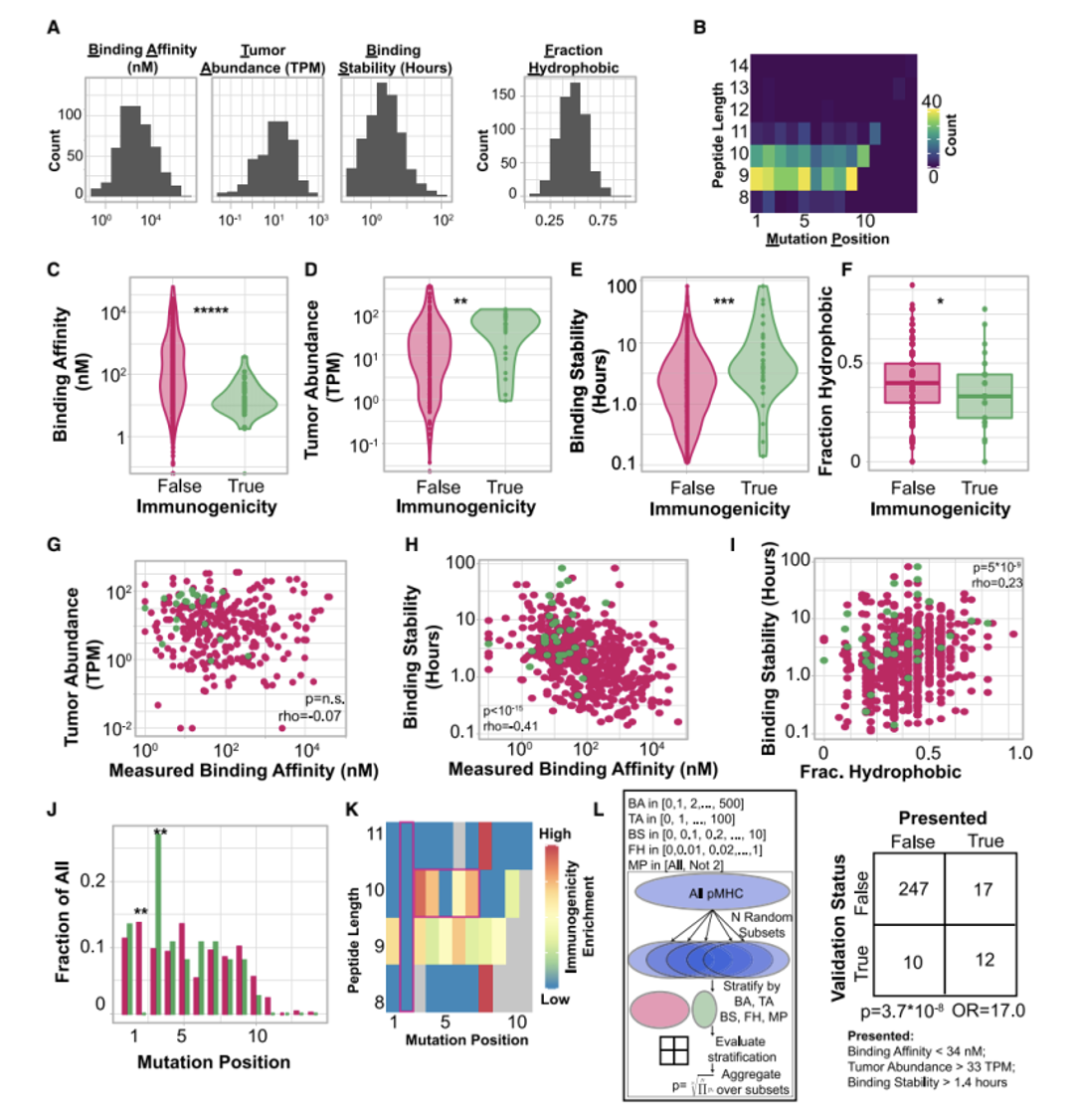
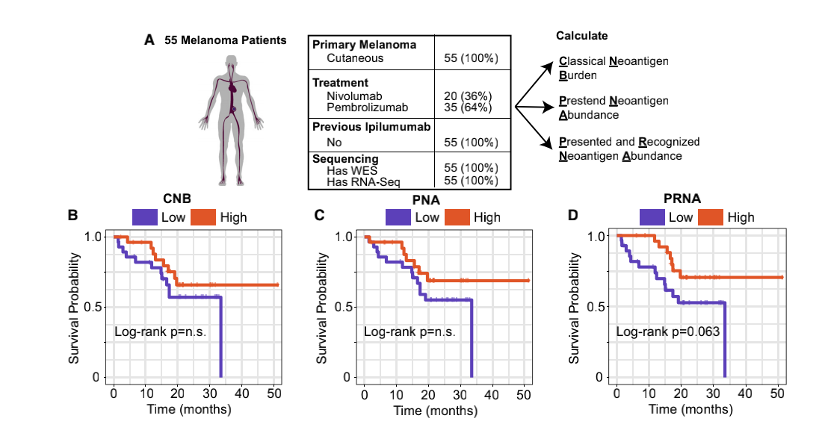
值得注意的是,每个团队在前100名的排序中都预测正确了1至20个具有免疫原性的抗原表位,然而不同队伍对它们的排序有很大差别。研究者通过交叉两个团队的预测,并根据pMHC的平均排名重新排列组合这些预测结果(图2B),更有可能产生整体改善的预测结果(图2F)。这些结果提出了一种改进新生抗原预测的方法,即通过交叉和排名方法将两个独立预测结果结合。同时也表明了新生抗原表位的预测需要像TESLA这样的联盟协同行业共同发展。接着,研究人员对产生和未产生特异性抗原T细胞的多肽特征进行分析。研究人员首先在免疫原性和非免疫原性pMHC中评估了与抗原呈递有关的“呈递特征”,包括MHC结合亲和力、结合时长与稳定性,肿瘤表达丰度、肽疏水性和突变位置。研究结果显示,与非免疫原性的pMHC相比,免疫原性pMHC具有更强的结合亲和力(图3C),肿瘤丰度明显升高(图3D),结合稳定性显著提高(图3E),且疏水性显著降低(图3F)。结合强度与表达丰度不相关,同结合稳定性负相关。而结合稳定性则与疏水性正相关(图3G H I)此外,具有免疫原性的多肽上常由9或10个氨基酸组成,其中的突变常发生在第三个氨基酸,而几乎不发生在第二个氨基酸。(图3J K L)基于上述特征,研究人员采用了随机重复采样的方式确定了它们的阈值,分别是结合强度小于34nM,肿瘤丰度大于33TPM和结合稳定性大于1.4小时。通过阈值筛选可以过滤掉93%的非免疫原性肽,同时保持了55%的免疫原性肽(图3L)。
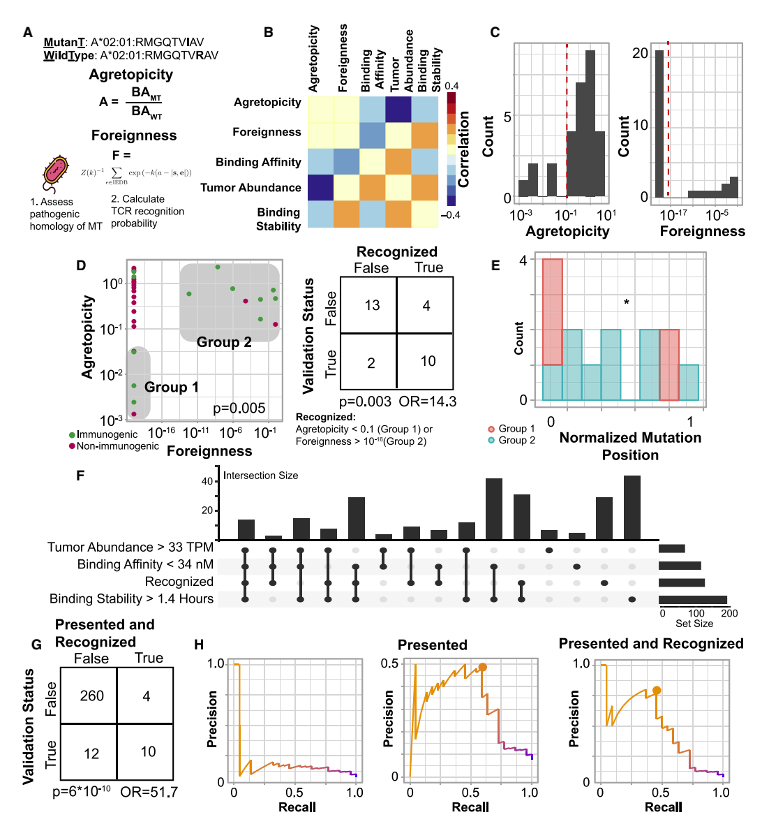
研究人员接着考量了两个与多肽识别有关的特征:“聚合性”——突变多肽与正常多肽结合亲和度的比值;“外来性”——同源病原性多肽的TCR识别概率。在29个pMHC中,研究显示低聚合型或高外来性的多肽会被识别,这两个特征仅在最有可能呈递的肽中与免疫原性相关。通过整合呈递特征与免疫原性肽识别特征,研究者共发现了四种预测多肽免疫原性的特征,分别是高结合亲和度,高肿瘤丰度,高结合稳定性和多肽识别度。同时运用这四种特征可以排除98%的无免疫原性多肽,并保留45%具有免疫原性的多肽。相应地,在预测中给这些特征施加更高权重的团队通常能够产生更精确的预测结果。肿瘤突变负荷是免疫检查点抑制剂治疗的生物标志物之一,但其在黑色素瘤中对免疫检查点抑制剂治疗疗效的预测仍然有争议[3]。那么,上述文中提到的与新生抗原预测有关的特征是否能够在黑色素瘤中提高对免疫治疗的预测效果?研究人员基于以上影响新生抗原预测的“抗原呈递”和“多肽识别”相关特征开发了新生抗原负荷(PRNA),将PRNA对免疫治疗疗效预测效果与仅考虑MHC结合强度计算的新生抗原负荷CNB以及预测新生抗原丰度的PNA相比较,结果显示,在55例接受免疫检查点抑制剂治疗的黑色素瘤患者中,PRNA能够更好的预测接受ICB治疗的黑色素瘤患者的生存时间(图5)。最后,为了在其他独立的队列中验证该预测模型相关特征。研究人员对3个黑色素瘤患者的WES和RNAseq数据进行分析,在310个pMHC中,有4个具有免疫原性(图6A)。免疫原性多肽明显具有更强的结合亲和力(图6B)、更高的肿瘤丰度(图6C)和更长的结合稳定性(图6D)。对这些多肽使用相同的重复随机采样,确定了一个包含这三个特征的阈值集,该阈值集过滤了97%的非免疫原性肽,同时保留了75%的免疫原性肽(图6E)。在其余10个符合所有“呈递”标准的pMHC,同样也100%符合“识别”标准(低聚合性和高外来性)(图6F)。符合这种“呈递”和“识别”特征的pMHC可以达到75%的召回率以及过滤掉99%的非免疫原性pMHC(图6G)。这表明同时考虑抗原呈递和识别的预测模型显著提高了预测的精确率和召回率。
1.测试的多肽来源于小的体细胞变异,未考虑复杂的变异结构;
2.验证中识别与T细胞特异性相关的肽,忽略了新生抗原的免疫原性可以通过适当的疫苗接种方法增强;
3.验证中只关注MHC-I限制性抗原,没有考虑到MHC-II限制性抗原和CD4+ T细胞的作用;
4.采用的方法关注于患者匹配样本中肿瘤抗原的免疫原性,未解决同种异体背景下的规则。
但总体来看,这项研究依然提升了人们对于肿瘤新生抗原免疫原性预测的能力,并为未来的比较研究提供了基础。
参考文献:
[1] Sahin, Ugur. et al (2017). Personalized RNA mutanome vaccines mobilize poly-specific therapeutic immunity against cancer. Nature, 547(7662), 222–226. doi:10.1038/nature23003[2] Wells, D. K. et al. (2020). Key Parameters of Tumor Epitope Immunogenicity Revealed Through a Consortium Approach Improve Neoantigen Prediction. Cell. doi:10.1016/j.cell.2020.09.015
[3] Luksza, M. et al. (2017). A neoantigen fifitness model predicts tumour response to checkpoint blockade immunotherapy. Nature 551, 517–520.
【 返回列表 】