近期,中山大学肿瘤防治中心张力教授、方文峰教授团队联合裕策生物发表了题为 “ Intratumoral heterogeneity as a predictive biomarker in anti-PD-(L)1 therapies for non-small cell lung cancer” 的文章。该研究揭示了肿瘤内异质性(ITH)是影响肿瘤免疫检查点抑制剂治疗疗效的重要因素,同时指出了 ITH 具有较强的通用性与兼容性:适用于不同的瘤种,而且在肿瘤组织和外周血中均有所表现,不限于检测技术手段(WES 或 panel 均可)。研究中ITH 是肿瘤突变负荷(TMB)的有效补充,可解释某些TMB 指标不适用的情况。ITH 或将成为肿瘤免疫治疗的另一重要生物标志物。

这一研究成果公布在 2 月23日的 Molecular Cancer(2019 IF 15.3,实时影响因子>26)杂志上,中山大学肿瘤防治中心方文峰教授、裕策生物金皓玄博士、中山大学肿瘤防治中心周华强博士和洪少东教授为文章共同第一作者,通讯作者为中山大学肿瘤防治中心张力教授和裕策生物高志博博士。下面,小编就为大家详细解读这项研究结果。
在过去十年内,免疫检查点抑制剂(ICIs)在肿瘤的临床治疗中取得了显著的进展。以 CTLA-4、PD-1 和 PD-L1 为靶点的 ICIs 可促进 T 细胞的抗肿瘤反应,显著延长患者生存期,目前已有多款药物在国内外获批。但是免疫治疗也存在有效人群占比不高、耐药、超进展等问题,只有约 20% 的患者能够从 ICIs 单药治疗中获益,因此迫切需要寻找有效的生物标志物来筛选获益人群。目前被广泛接受的生物标志物(例如 PD-L1,TMB)并不够完善,一些 TMB 低或 PD-L1 阴性的患者仍能从免疫检查点抑制剂中获益。
近年来,肿瘤内异质性(intratumoral heterogeneity,ITH)受到了越来越多的关注,被认为是影响肿瘤免疫耐药的主要因素之一。ITH 实际上可认为是单个肿瘤中基因组多样性在空间或时间上的不均匀分布,由不断累积的基因突变所造成,这对精准的肿瘤治疗提出了相当大的挑战。2019 年,以色列魏茨曼科学研究院的 Yardena Samuels 教授与美国国家癌症研究所的 Eytan Ruppin 教授联合团队发表的 Cell 文章中指出,在黑色素瘤中的 ITH 越高,免疫系统被抑制的程度越高,癌症进展更快,免疫治疗效果越差。
而 ITH 是否同样能够影响其他瘤种对免疫治疗的敏感性仍未有详细报道。为了探究该问题,研究团队在非小细胞肺癌以及多个 ICIs 治疗泛瘤种队列中对 ITH 的表现进行了综合评估。
优化后的 ITH 算法成功实现单点取样即可估算患者的整体 ITH 程度
传统的肿瘤内异质性(ITH)计算方法主要通过多点取样的方式,综合评估各个取样位点的基因突变情况,进而计算出患者整体的 ITH 程度。张力教授团队曾在 2019 年 Molecular Cancer 上发表了一项肺癌 ITH 研究,通过多点取样获得了 32 例肺癌患者的 181 个不同区域的病灶,经测序分析后发现携带 EGFR 突变的肺癌患者具有更高的 ITH index,据此认为ITH 可能是导致 EGFR 突变肺癌患者整体免疫治疗响应较差的原因之一。
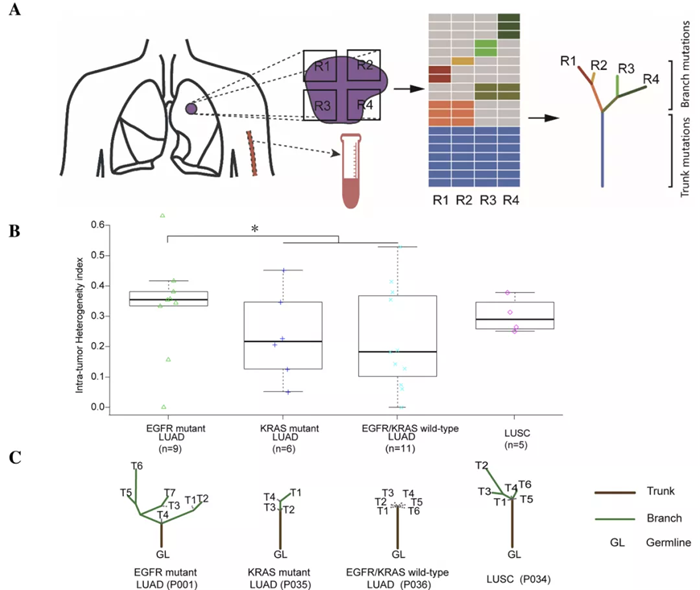
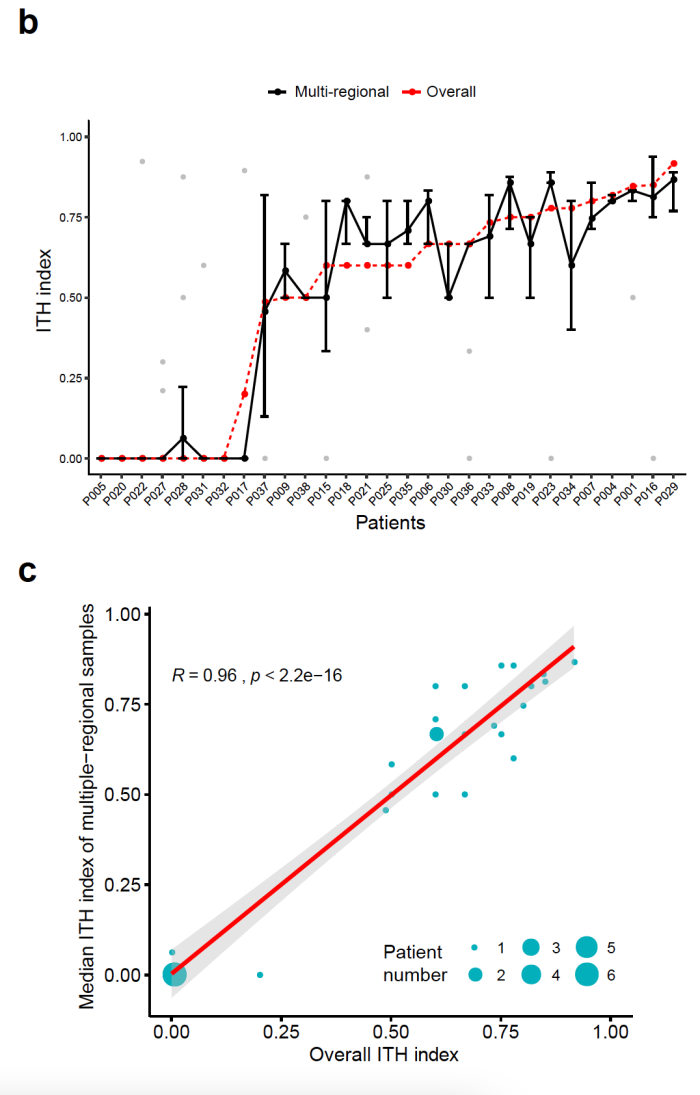
然而这种多点取样计算 ITH 方法的可行性较差,很难在实际临床上应用和推广。因此,为解决这一临床上的难题,张力教授和方文峰教授团队联合了裕策生物,对 ITH 的算法进行优化:通过基因的突变频率,拷贝数和杂合性缺失信息,估算出肿瘤中不同突变频率模式的细胞群体,区分出主克隆和亚克隆后计算整体的 ITH,并尝试使用单次取样的整体 ITH 来代表整个肿瘤组织多点取样的 ITH。结果显示,基于新算法计算的整体单次取样 ITH在很大程度上可代表多点取样的 ITH,并且与患者多点取样 ITH 中位值高度相关,系数达 0.96,说明了使用该算法计算 ITH 具有相当高的可靠性。解决了这个问题后,研究团队便能在更多的队列中探究 ITH 对免疫治疗响应的影响。
ITH 单独或联合 TMB 能预测非小细胞肺癌的免疫治疗疗效
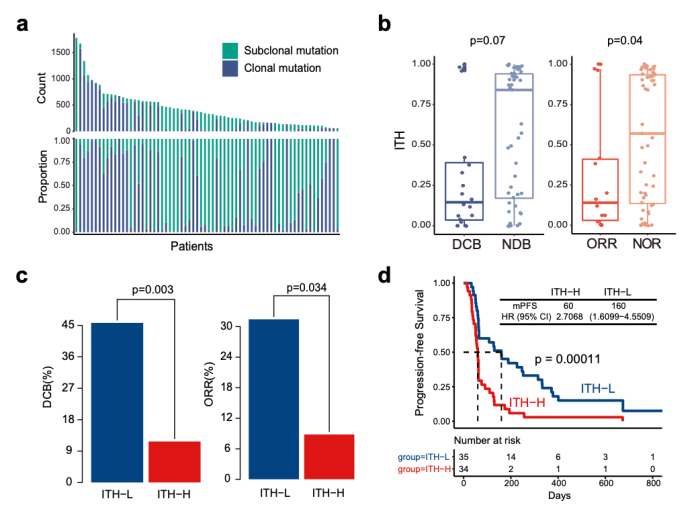
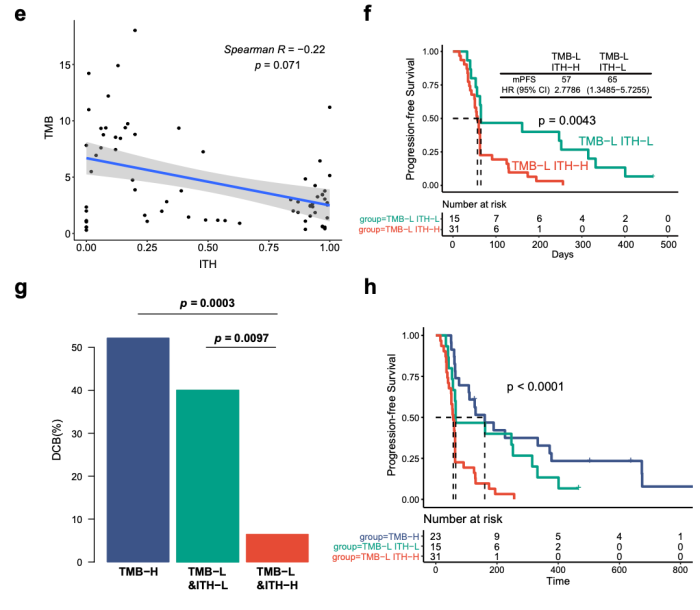
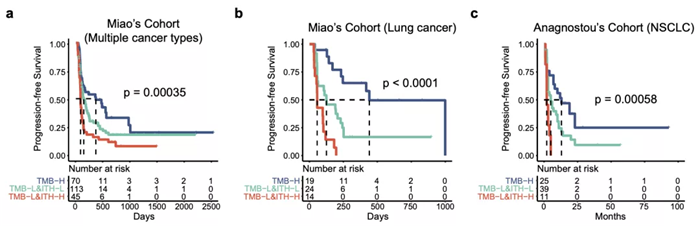
研究团队首先利用中肿 69 例二线接受PD-(L)1 单抗单药治疗的非小细胞肺癌(NSCLC)队列进行研究,发现除了 TMB 外,ITH 在不同免疫治疗疗效患者中的分布也具有显著差异。ITH-L 的患者具有更高的客观缓解率和更长的无进展生存期 (DCB: 45.7% vs 11.8%, p = 0.003; ORR: 31.4% vs 8.8%, p = 0.034; mPFS: 160 vs 60 days, p = 0.0001, HR =2.71)。此外, ITH 分布与 TMB 并无显著相关性,可以认为是两个互相独立的指标。当联合 TMB 后,ITH 能够在 TMB-L 的患者中进一步区分出疗效好和疗效差的两组,其中 TMB-L 且 ITH-H 的患者,疗效最差,对 ICIs 几乎不响应 (DCB: 6.5%, ORR: 3.2%)。
ITH 的疗效预测能力在多个免疫治疗队列中得到验证,并在 ctDNA 中具有应用潜力
同时,研究团队也引入了多个 ICIs 免疫治疗队列对 ITH 的疗效预测能力进行验证。在 Miao 的多癌种数据集和 Anagnostou 肺癌数据集里面,同样发现了 ITH 单独或联合 TMB 的免疫治疗疗效预测能力。无论是整个队列还是 TMB-L 患者群体,ITH-L 患者的生存曲线显著优于 ITH-H。让 ITH 这个 biomarker 得到了进一步的验证。
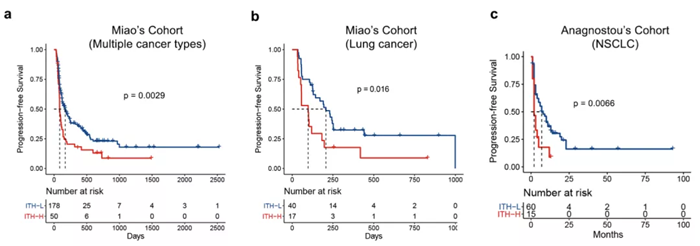
随着肿瘤检测技术的发展,液体活检的重要性得到越来越多的认可,尤其是外周血循环肿瘤 DNA(ctDNA)。为了探究 ITH 的预测效果能否适用于 ctDNA 数据,研究团队也引入了 POPLAR 和 OAK 两个免疫治疗队列。结果发现,在 POPLAR/OAK 的低 ITH 患者生存期有延长的趋势,但未达到统计学意义。进一步分析发现,血液肿瘤突变负担高 (bTMB)-H 组患者获得了最好的临床获益,其次是 bTMB-L & ITH-L 组和 bTMB-L & ITH-H 组,这与研究的主要结果相一致。此外作者还对比了 POPLAR 和 OAK 队列的化疗组中 ITH 的表现,发现化疗组的结果不显著,提示 ITH 是 ICIs 治疗响应的预测因素。
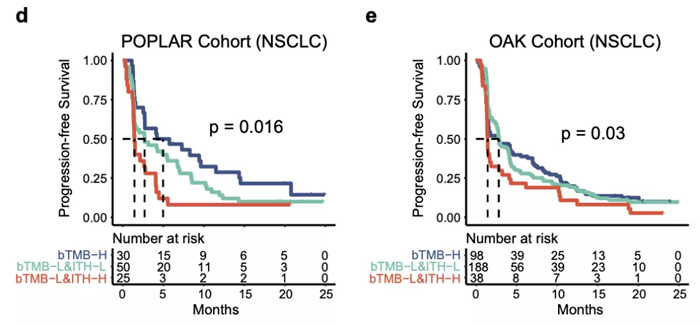
这一发现不仅进一步验证了 ITH 在预测 NSCLC 免疫治疗临床获益方面的稳定性,而且提示我们将来利用 ctDNA 检测这种经济、通用且无创的方法去推广和应用 ITH。
泛肿瘤中的 ITH 与免疫治疗之间关系
此外,研究团队还通过 TCGA 数据库,计算出了 ITH 在 20 多个癌种中的分布,发现 ITH 在不同肿瘤中的分布差异巨大。将各癌种的 ITH 中位值与这些肿瘤目前 ICIs 免疫治疗的客观缓解率进行相关性分析,发现中位 ITH 水平越低的瘤种,其抗 PD-(L) 1 治疗的有效率越高的显著性趋势,这为不同肿瘤的免疫治疗客观缓解率差异提供了一个新的解释机制。
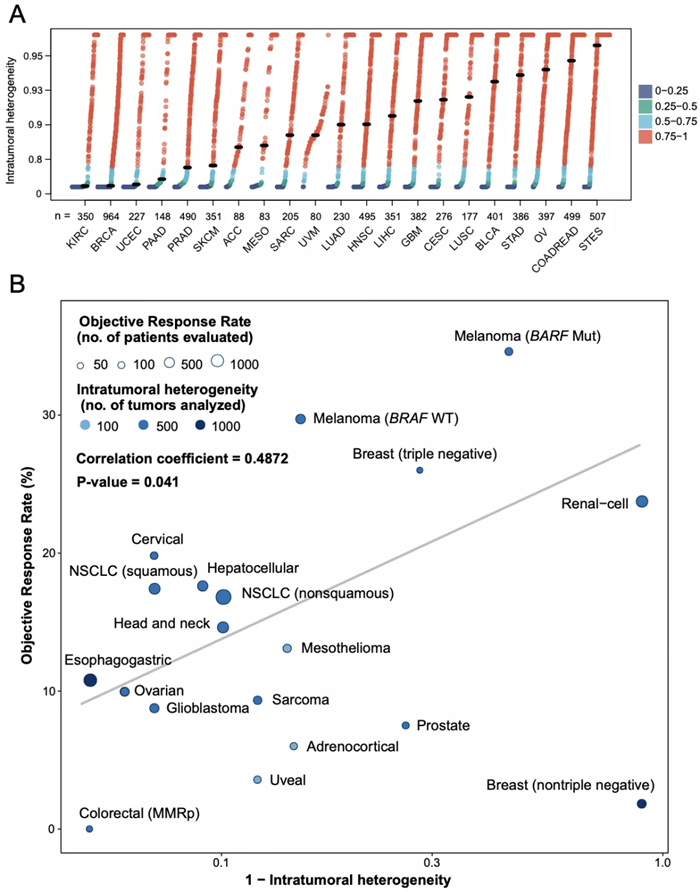
具体对于除 NSCLC 以外的肿瘤类型,ITH 是否也同样适用呢?研究团队主要通过分析 MSKCC 的泛癌种免疫治疗数据对 ITH 的预测效果进行了全面评估。发现在黑色素瘤、食管 / 胃癌、头颈癌、肾癌中 ITH 能够区分不同疗效的患者群体,进一步扩大了 ITH 潜在应用的癌症类型。值得注意的是,此处所使用的 MSKCC 泛癌种数据集,包括前面提到的 POPLAR 和 OAK 数据集,均是基于 Foundation Medicine 的组织和血液 panel 检测的数据。这也从侧面说明了 ITH 不仅在 WES 检测中有效,也能在 panel 数据中进行预测,大大提高了 ITH 作为免疫治疗疗效预测 biomarker 在不同平台上的适用性。
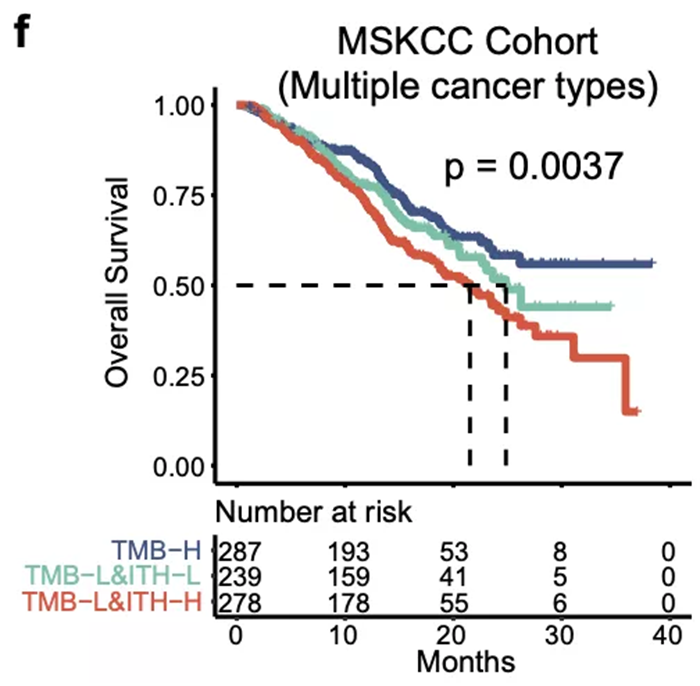
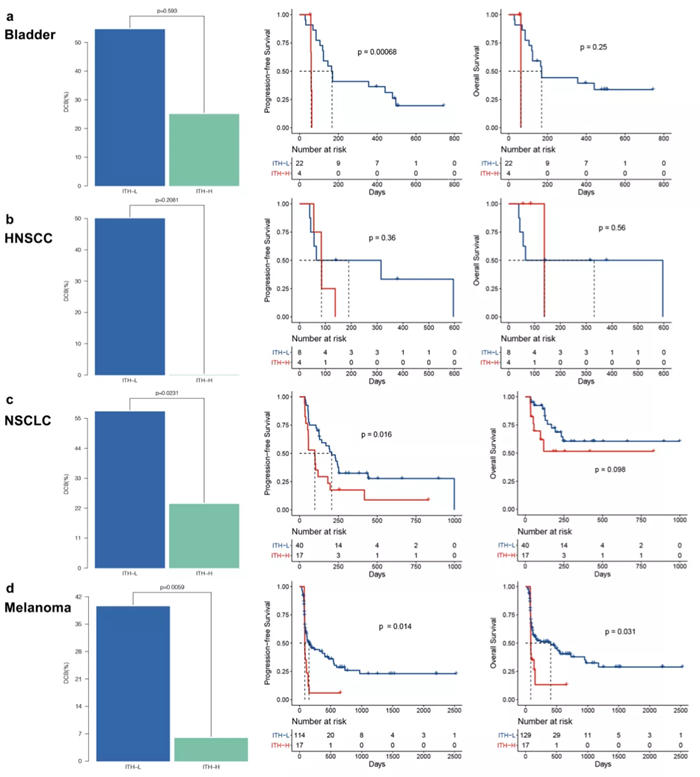
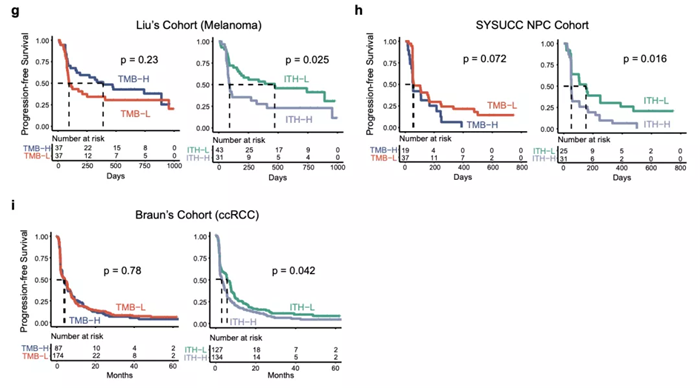
此外,研究团队还在鼻咽癌和透明肾细胞癌两个免疫治疗队列中成功验证了 ITH的预测价值,而这两个癌种的 TMB 为中等水平且无法通过 TMB 预测疗效。这提示了 ITH 能够成为 TMB 的有效补充,在 TMB 不适用的情况下发挥免疫治疗疗效的预测能力。
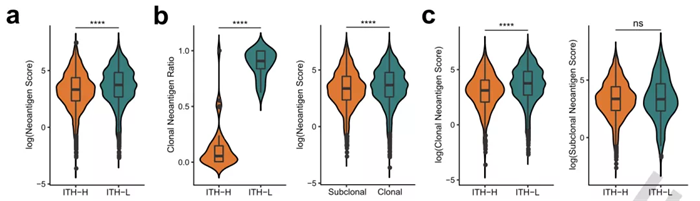
ITH 与肿瘤新生抗原
为了进一步探究 ITH 的内在机制,研究对 NSCLC 队列中 ITH-L 和 ITH-H 患者群体的肿瘤新生抗原进行了预测和统计分析。发现 ITH-L 患者有较高比例的主克隆新生抗原,而且这部分新生抗原与 MHC 分子具有较高的亲和力。说明了低 ITH 的患者在免疫治疗过程中对新生抗原的识别和呈递能力表现较好,这也在一定程度上解释了这部分患者对 ICIs 的响应较好的现象。
综上所述,研究团队将 ITH 与 TMB 有机地结合起来,阐释了影响患者免疫治疗响应的重要因素。高 TMB 是免疫治疗响应的积极因素,而高 ITH 是免疫治疗响应的消极因素。TMB-H & ITH-L 类型的患者具有更高比例的主克隆突变,且大部分具有免疫原性的新生抗原都来自于肿瘤的主克隆,一旦被 T 细胞识别即可引起抗肿瘤反应,理论上携带该突变肽段的大部分肿瘤细胞都会被清除,因此免疫治疗的效果最好。TMB-L & ITH-H 类型的患者免疫治疗效果最差,不仅具有免疫原性的新生抗原数量少,而且大部分分布在肿瘤的亚克隆当中,因此只有少量的肿瘤细胞会被清除,对肿瘤免疫反应所起的作用有限。而 TMB-H & ITH-H,TMB-L & ITH-L 类型患者的免疫治疗疗效则介于前两者之间。
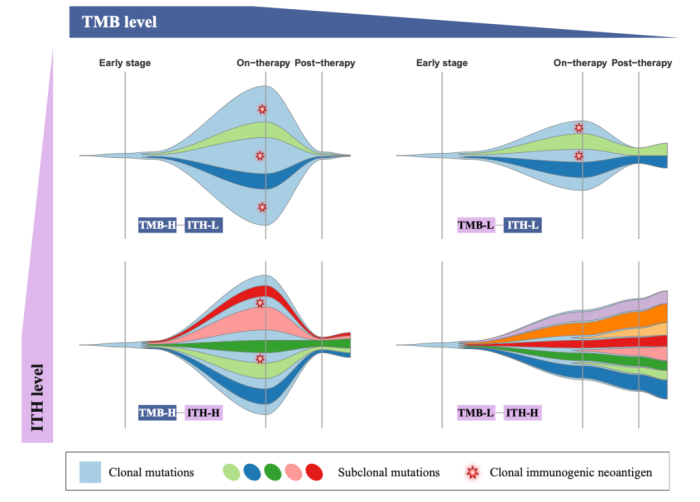
ITH 亮点总结
1. 独立性:ITH 与 TMB 的相关性低,可单独作为 biomarker 使用,也能联合 TMB 预测免疫治疗疗效。
2. 广泛性:ITH 不仅在非小细胞肺癌中得到充分验证,也在黑色素瘤、鼻咽癌、头颈癌等瘤种中得到验证,可适用于不同的瘤种。
3. 无创性:ITH 的检测不仅适用于组织样本,也能通过液体活检方式进行。
4. 兼容性:ITH 的检测不仅能够在 WES 平台上进行,也能够在成本更低、通量更高的大 panel 平台上进行。
ITH 的局限性
虽然 ITH 会是一个非常有潜力的免疫治疗疗效预测 biomarker,但是仍存在一些局限性:
1. ITH 的阈值有待确定。这与肿瘤类型有关,也与突变检测的过滤标准有很大关系。
2. 尚未探究 ITH 与其他常见的免疫治疗相关 biomarker 之间的关系,如 PD-L1 表达和微卫星不稳定性。
3. 基于组织和血浆的 ITH 计算是否具有相关性在本研究中尚未涉及。
4. ITH 在肿瘤进展中如何发挥作用的生物学机制解释仍未清楚。
最后,本研究中所有数据均为回顾性数据,后续仍需要前瞻性临床研究数据进行验证。
结语
本研究是首个在多瘤种中验证 ITH 对于免疫治疗疗效预测价值的研究,也是首个在泛癌种水平上发现ITH 中位值与免疫治疗疗效之间存在相关性,同时创新性地利用不同检测方式和样本来源的数据分析 ITH 的可行性。研究团队首先使用优化后的 ITH 算法成功实现单点取样即可估算患者的整体 ITH 程度,使得 ITH 具备了实际临床上应用和推广的可行性。进一步发现,ITH 是潜在的免疫治疗生物标志物,可预测晚期 NSCLC 患者的疗效,甚至可以预测其他瘤种患者接受 ICI 治疗的疗效。它在低 TMB 人群中的表现最为突出,提示 ITH 和 TMB 的综合评估可进一步扩大 ICI 治疗优势人群。更可喜的是,ITH 不仅适用于不同瘤种,而且在肿瘤组织和外周血(ctDNA)中也能有所表现,并且不限于检测的方式(WES 或 panel 均可),这种通用性和兼容性展现出 ITH 作为免疫治疗 biomarker 的潜在临床应用优势。
延伸
寻找和探究免疫治疗的疗效预测生物标志物一直是裕策生物的重要探索方向,是践行 “让肿瘤免疫更有效” 使命的重要一环。虽然 TMB 的发现为肿瘤免疫检查点抑制剂治疗提供了一个可参考的标准,但是在临床应用时 TMB 的局限性也逐步显露。最大的问题在于 TMB 的计算对所有的突变都 “一视同仁”,但实际上是不是这样呢?近年来的一些优化 TMB 算法的文章,如 “clonal TMB”,“HLA-corrected TMB” 等,都是基于不同突变对肿瘤免疫反应的贡献存在差异这一理论假设,而造成这种差异的根本原因之一就是肿瘤内异质性。肿瘤免疫治疗起作用的核心之一是具有免疫原性的新生抗原被识别和呈递,进而激活 T 细胞的抗肿瘤反应,TMB 可以理解为对肿瘤新生抗原数量的描述,而 ITH 则是新生抗原质量的描述。肿瘤内异质性低意味着更高比例的具有免疫原性的主克隆突变在大部分肿瘤细胞中存在,一旦被 T 细胞识别引起抗肿瘤反应,理论上携带该突变肽段的大部分肿瘤细胞都会被清除;而肿瘤内异质性高则意味着具有免疫原性的突变肽段会分布在亚克隆肿瘤细胞中,只有少量的肿瘤细胞会被清除,因此这些患者的免疫治疗效果较差。ITH 作为一个肿瘤内在的耐药因素,早在 2016 年,就被发表在 Science 上的一项研究报道能够提高肿瘤新生抗原负荷 (TNB) 对 ICIs 疗效预测的准确性。TNB 高且 ITH 低 (即亚克隆新生抗原水平低) 的 NSCLC 患者相比 TNB 低或 ITH 高的患者而言,临床获益显著增加;TNB 联合 ITH 的预测效果相比单独使用 TNB 预测,PFS 的 HR(Hazard Ratio, 即风险比率)更低。随后,Miao 等研究者同样观察到对 ICIs 产生应答的 MSS 型实体瘤患者,克隆性非同义突变显著高于无应答患者,而其亚克隆性突变低于疾病进展患者。2019 年,裕策生物发表在 AACR 上的 Poster 在使用 Nivo + 仑伐替尼联合治疗的肝内胆管癌患者中证实了上述结论,发现 TNB-H 且 ITH 低的患者相比其他患者,趋向于具有更长的 PFS 及 OS。
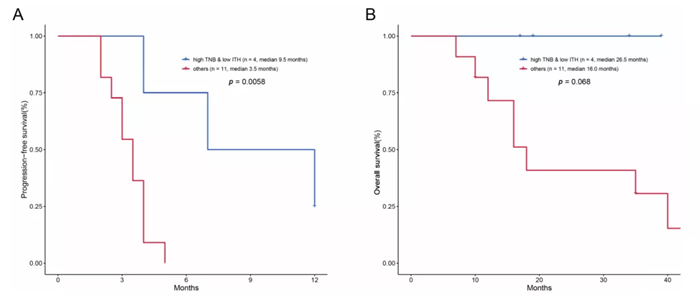
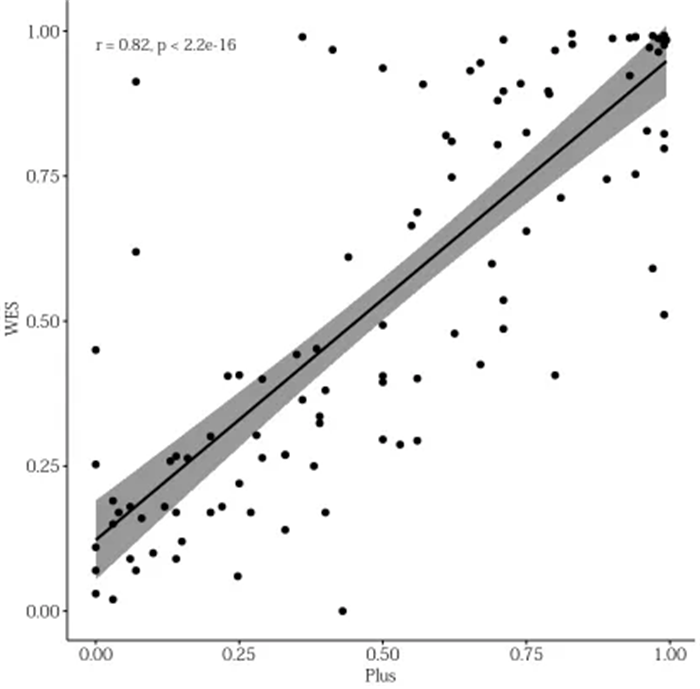
此外,除了 WES 所测 ITH 可以预测 ICIs 疗效,本研究还采用了 POPLAR/OAK 队列以及 MSKCC 的数据,观察到基于 Foundation Medicine 的大 Panel 产出数据计算的 ITH 同样可以在特定肿瘤和泛癌种中区分 ICIs 获益人群。考虑到大 Panel 相比 WES 的检测成本及周期更低,因此更有可能在临床上得到推广。然而,Panel 大小影响 ITH 检测的准确性,在成本可控范围情况下,Panel 应越大越好。裕策生物 2.31M 的 YuceOne® Plus 大 Panel 产品,相比 FM 的 Panel 更大 (约 1M),不仅能完全满足 TMB、TNB、HLA LOH、MSI、免疫正负向的指标的检测,还可以检测 ITH,助力临床科研。通过算法优化,YuceOne® Plus 大 Panel 产品和 WES 检测 ITH 的相关性为 0.82。
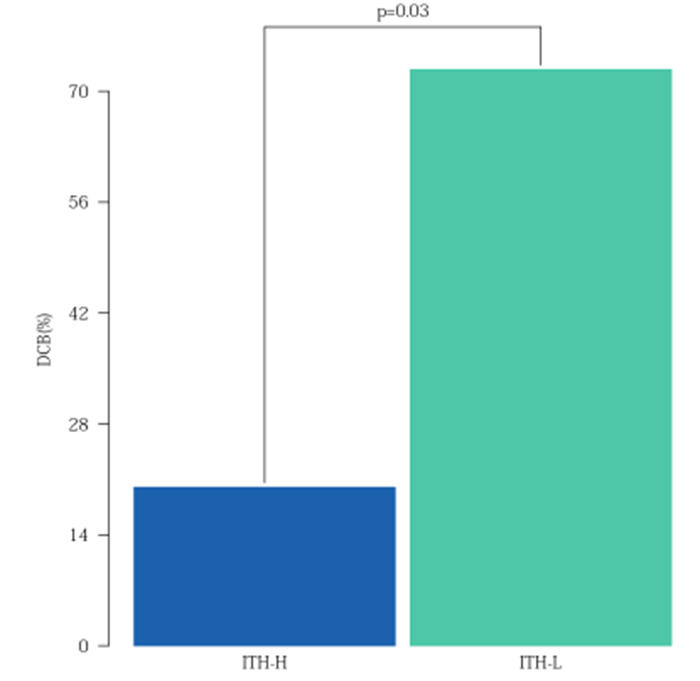
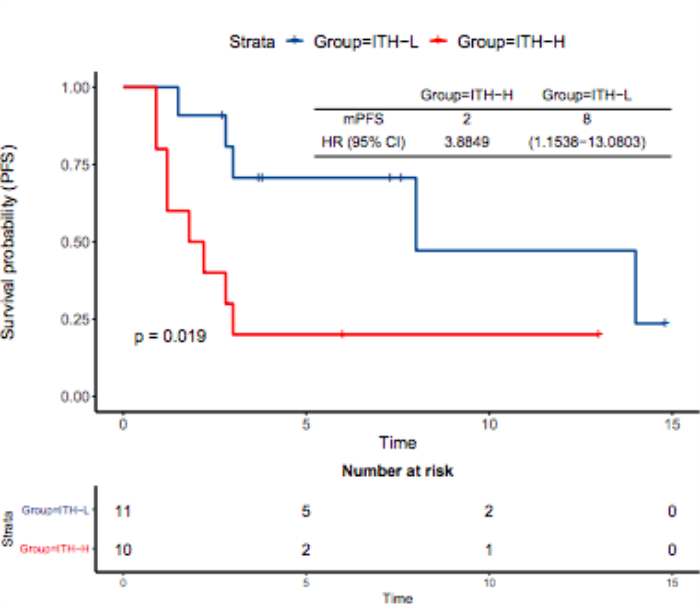
在免疫单药治疗的 NSCLC 队列中,使用 YuceOne® Plus 大 Panel 产品进行 ITH 检测,发现 ITH-H 相比 ITH-L 的患者 DCB 和 mPFS 显著降低。ITH 与其他生物标志物联合使用有望提高 ICIs 疗效预测的准确性。
参考文献
1.Mol Cancer. 2021 Feb 23; 20:37. doi: org/10.1186/s12943-021-01331-9.
2.Cell. 2019 Sep 19;179(1):219-235.e21. doi: 10.1016/j.cell.2019.08.032.
3.Mol Cancer. 2019 Jan 9;18(1):7. doi: 10.1186/s12943-019-0939-9.
4.Science. 2016 Mar 25;351(6280):1463-9. doi: 10.1126/science.aaf1490.
5.Nat Genet. 2018 Sep;50(9):1271-1281. doi: 10.1038/s41588-018-0200-2.
6.AACR 2019, poster 2250.
【 返回列表 】
Copyright©2021
深圳裕策生物科技有限公司 版权所有
粤ICP备16128839号

