
抗PD-1/ PD-L1免疫疗法已作为许多癌症类型的二线治疗手段,并取得了巨大的临床成功,但多项抗PD-1 / PD-L1药物的临床试验回顾性研究结果显示,EGFR突变的NSCLC患者不能从抗PD-1 / PD-L1药物治疗中获益。尽管如此,长期随访这些临床试验发现仍有部分EGFR突变的NSCLC患者能够获得免疫治疗临床获益,对于这类患者对免疫治疗响应的机制,尚缺少分子层面的深入研究。
为此,华中科技大学同济医学院附属协和医院刘莉教授团队对在临床试验中发现的一例携带EGFR 19号外显子缺失突变并对免疫检查点抑制剂治疗响应的晚期NSCLC案例开展了回顾性研究,深入探索该患者产生抗肿瘤免疫应答的生物学机制。裕策生物参与其中的基因检测与数据挖掘工作。
案例展现
2017年1月,一名34岁男性患者,因胸部和背部疼痛就诊。支气管镜活检组织进行病理检测和基因检测,病理结果确认为T4N2M1b Ⅳ期的肺腺癌;基因检测结果为EGFR 19号外显子缺失突变。该患者于2017年2月开始接受EGFR-TKI药物埃克替尼治疗,5个月后,发生了获得性耐药,基因检测显示EGFR T790M突变。随后,他接受培美曲塞加奈达铂治疗4个周期,培美曲塞再治疗1个周期,直到2017年11月病情进展。
此后,该患者参加了Nivolumab单药治疗的3期临床试验(NCT03195491),该临床试验入组患者为之前系统性治疗失败的晚期NSCLC患者。于2018年6月进行了2个疗程的Nivolumab治疗。2018年8月患者出现头晕,MRI扫描结果显示病灶增大、左基底神经节水肿和伴随多处脑转移(下图C)。使用甘露醇脱水疗法后,又使用2个疗程的Nivolumab治疗。根据RECIST 1.1标准,他于2018年9月实现了部分缓解(PR),肺和脑转移灶的肿瘤退缩,并且总体耐受性良好。随后,患者每两周接受一次240毫克的Nivolumab静脉滴注,根据常规的CT / MRI检查,患者已维持PR超过1年(见下图)。
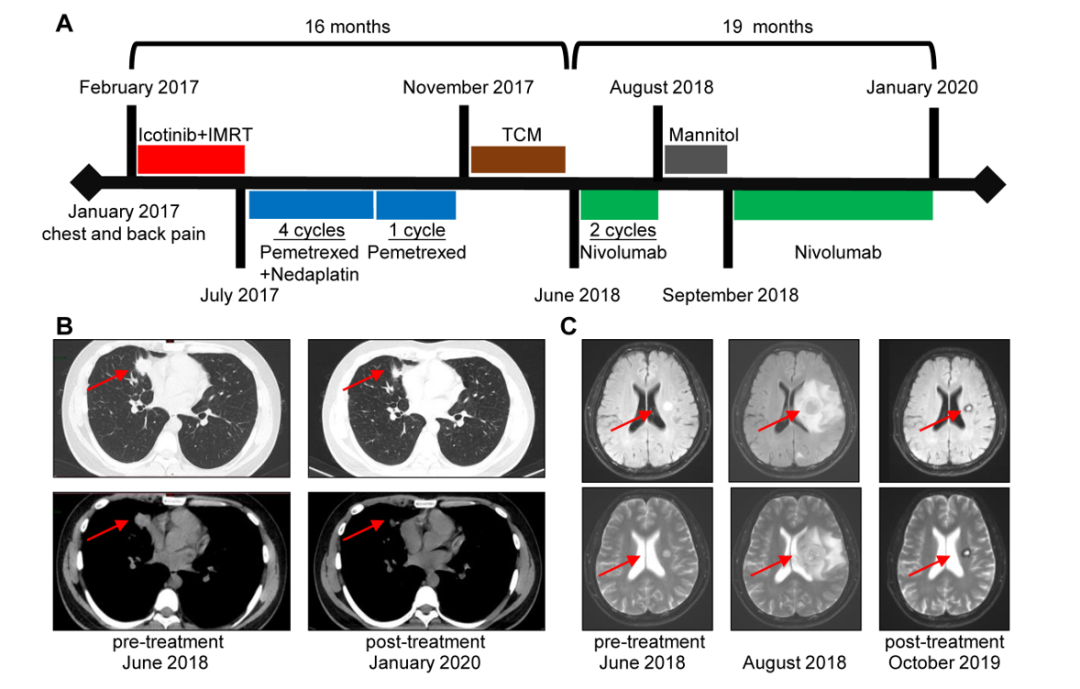
患者的治疗过程(A)、CT影像(B)以及MRI影像(C)
机制探索
为了研究免疫治疗的获益机制,我们对肿瘤组织进行了全外显子组测序(WES)、转录组测序(RNA-seq)和PD-L1免疫组化检测,并将治疗前后的血液样本中的外周血单核细胞(PBMC)进行免疫组库测序(IR-seq)。针对肿瘤组织的检测结果显示,肿瘤突变负荷中等水平(TMB = 6.00 muts / Mb),肿瘤新生抗原负荷中等水平(TNB=2.67 neos / Mb),PD-L1高表达(TPS ≥ 50%,下图A),未检测到EGFR突变外的免疫治疗相关负向指标。通过PBMC中T细胞受体(TCR)的频率变化,我们发现大多数高频克隆在治疗前后均稳定存在(下图B)。该结果提示免疫治疗前肿瘤组织和血液就存在能够识别和杀伤肿瘤细胞的T细胞,部分解释了整个免疫治疗过程的持久临床响应。
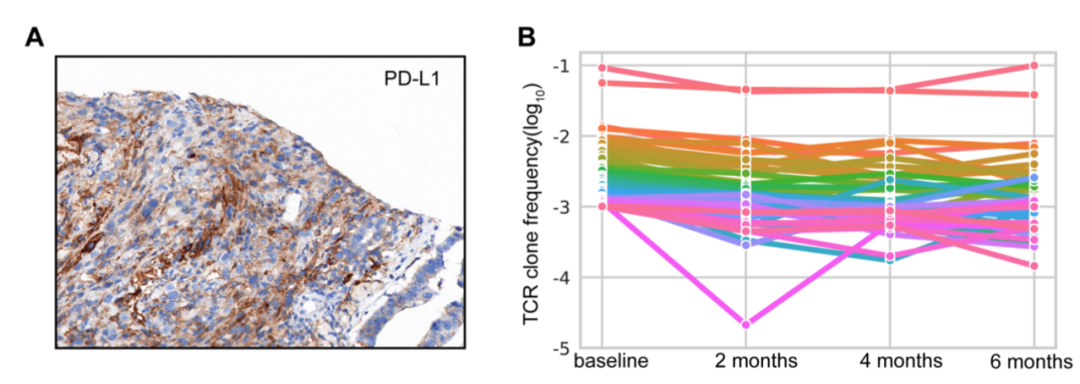
PD-L1免疫组化结果和基线血液样本中高频TCR监测结果:(A)PD-L1免疫组化;(B)基线血液样本中的高频TCR在治疗过程中的频率变化
为了进一步评估免疫治疗持久响应的潜在因素,我们分析了患者的HLA分型,并进行了新生抗原预测,最终筛选出13个由HLA-A * 11:01限制性呈递的候选高亲和力新生抗原肽进行实验验证。这13个新生抗原肽共来自6个基因(EGFR,TP53,POLA2,AP2AM1,DENND6B和TTC37)。其中,主克隆新生抗原源自EGFR,TP53和DENND6B突变,而POLA2,AP2AM1和TTC37突变仅可产生亚克隆新生抗原。
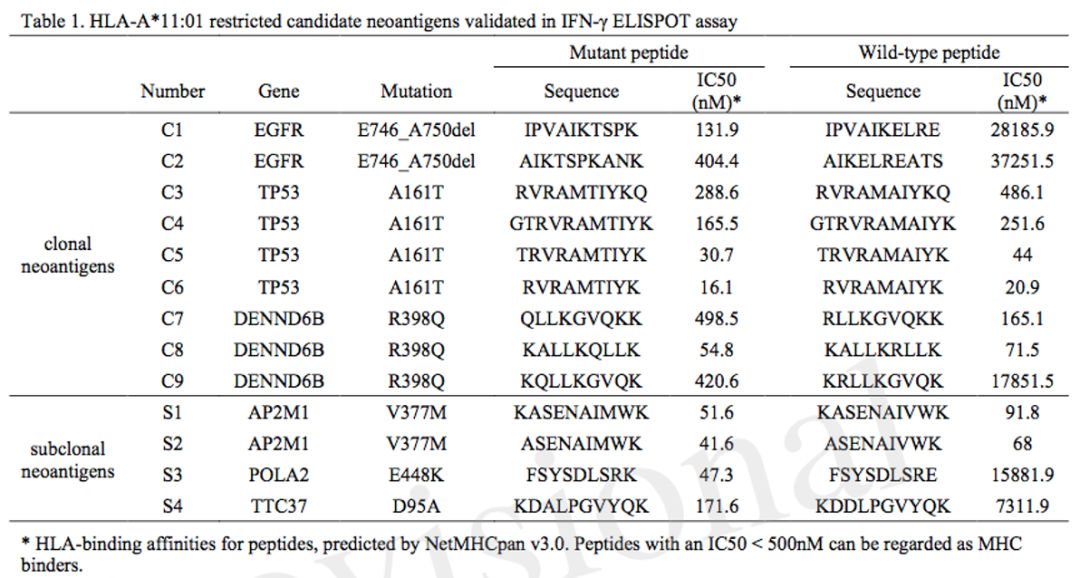
本案例中进行验证的13个新生抗原肽
刘莉教授团队首先基于新生抗原肽的序列,通过体外实验合成突变型和野生型肽。随后,她们采集患者的血液进行IFN-γ ELISPOT实验,以验证这些新生抗原的免疫原性。
结果显示,来自EGFR、TP53和DENND6B基因的4条新生抗原肽可以引起显著的免疫响应。
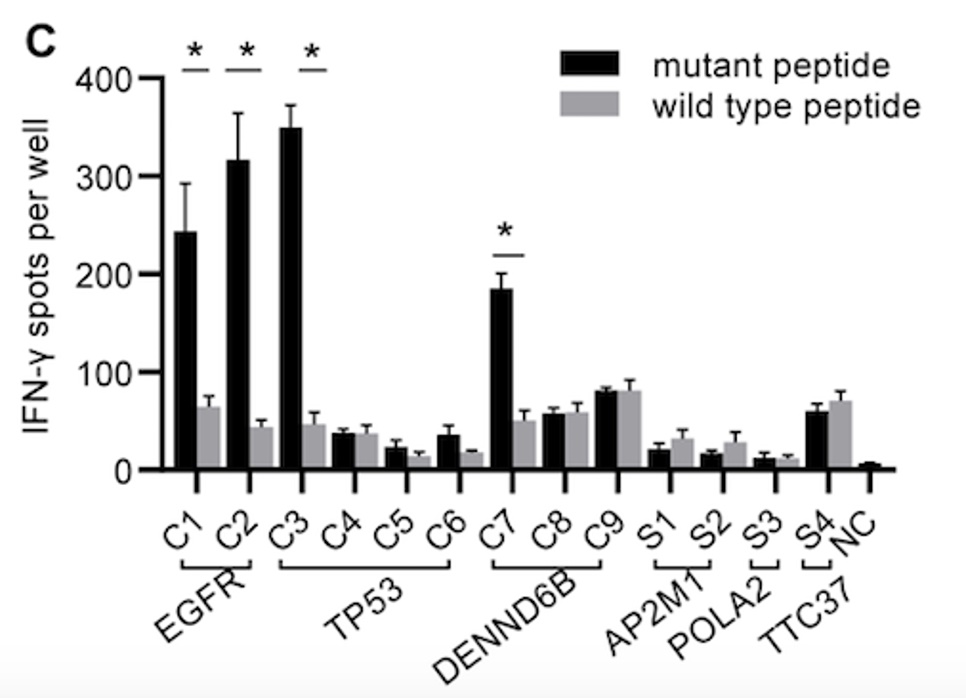
IFN-γ ELISPOT实验结果图示
随后,我们对这4条新生抗原肽及对应野生型肽的IFN-γ ELISPOT后样本进行了IR-seq,以分析能够识别新生抗原肽的TCR序列。结果显示,在用新生抗原刺激PBMC后,突变肽刺激的某些T细胞克隆频率显著高于相应的野生型肽刺激的克隆频率,并被定义为显著扩增的TCR克隆,即可以特异性识别新生抗原。我们将显著扩增克隆与患者血液样本中的TCR克隆进行匹配发现,有18个TCR克隆在治疗前后保持高频率,并且在Nivolumab治疗后动态监控样本中检测出7个TCR克隆发生显著扩增(见下图)。
说明EGFR、TP53等驱动基因突变产生了这些高质量的新生抗原,并刺激机体产生特异性的T细胞。同时O药解除了免疫检查点的抑制作用,使得免疫细胞发挥应有的抗肿瘤效应。
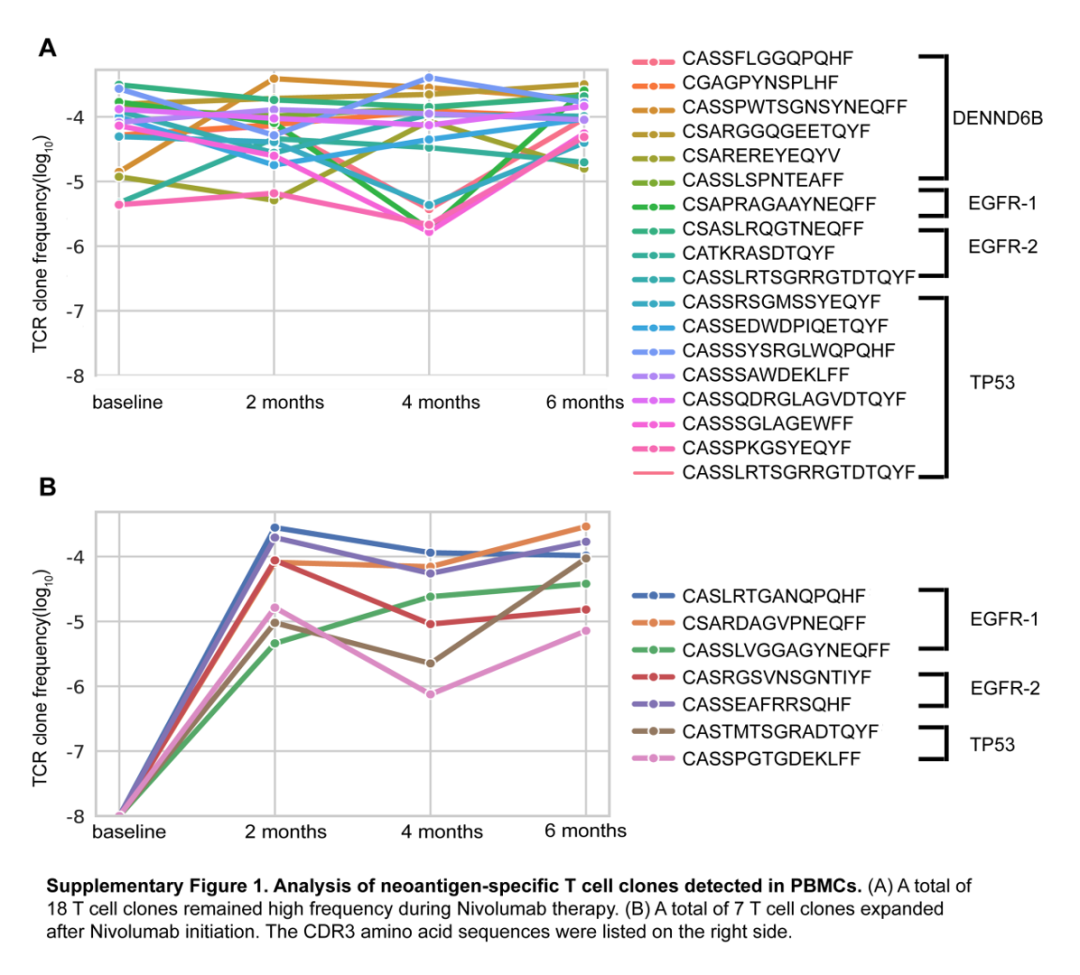
治疗前后血液样本中可识别新生抗原的TCR频率监测结果
结论
本案例显示EGFR驱动基因突变可以产生高质量的新生抗原,并且具有高免疫原性。在这种情况下,免疫检查点抑制剂可用于对EGFR-TKI具有耐药性的晚期NSCLC。
同时,本案例提示针对相关的特异性新生抗原的个性化免疫调节疗法或许可以为更多患者带来持续的生存获益。
专家点评
免疫检查点抑制剂(ICI)近年来在肺癌的临床表现非常喜人。但是ICI的整体人群有效性较低。临床上如何通过biomarker筛选免疫治疗的获益人群是一个热点问题。
PD-L1表达是目前被用作ICI治疗临床较认可的biomarker。先前的研究表明,EGFR信号通路可以从本质上上调肿瘤PD-L1表达,并有助于EGFR突变的NSCLC的免疫逃逸。然而,现实世界的研究有相反的结果,PD-L1在EGFR野生型NSCLC中的表达水平较高。该案例中患者的PD-L1肿瘤比例评分(TPS)≥50%,这可能有助于他对ICI的持久响应。但是,一些PD-L1高表达的患者因免疫治疗而意外失败。相反的结果表明,PD-L1表达可能不是具有EGFR驱动基因突变的NSCLC免疫治疗可靠的预测biomarker,仍然需要新的有效biomarker。
目前TMB也被认为是ICI治疗非常有潜力的biomarker。与低TMB的患者相比,高TMB的患者对抗PD-1 / PD-L1药物的客观响应更好。同样, TNB是在转录水平或蛋白质水平诠释了这些突变,被认为是TMB的替代物。但是,一些研究表明,TNB较高的患者可能仍对ICI耐药。因此,鉴定高质量的新生抗原可以优化对肿瘤已有免疫力的预测。
我们提出了结合计算机技术和体外方法来鉴定真正的新生抗原。在大部分肿瘤细胞中表达的新生抗原被定义为主克隆新生抗原,相对而言,亚克隆新生抗原就可能是在肿瘤进化过程中产生的,其介导免疫逃逸并促进肿瘤侵袭。在这项研究中,我们在IFN-γELISPOT分析中仅检测到了T细胞对主克隆新生抗原的响应,这在一定程度上可以解释为通过Nivolumab治疗后亚克隆新生抗原丢失了。在此情况下,总共验证了4种主克隆新生抗原,包括2种来自EGFR 19del的抗原,1种来自TP53 A161T的抗原和1种来自DENND6B R398Q的抗原。尽管针对EGFR突变的免疫疗法已被广泛讨论),但尚未有研究鉴定NSCLC患者中由EGFR突变产生的新生抗原。
先前的研究表明,外周血中的记忆T细胞可对肿瘤组织中的新生抗原产生响应,新生抗原的刺激会富集CD8 + /PD-1 + 的 T细胞亚群。我们以前的研究已经确定了NSCLC患者外周血TCR是一种有用的预后biomarker。在这项研究中,我们研究了TCR频率的动态变化,发现高频T细胞克隆的维持可能与对Nivolumab的持久响应有关。通过比较新生抗原肽刺激后的每个T细胞克隆,我们鉴定了一些新生抗原特异性T细胞克隆,这些克隆可能负责识别MHC。最近的一项研究提出了免疫疗法后克隆替代的假说,研究人员发现扩展的T细胞克隆是从血液中募集的,而不是连续地存在于肿瘤中。与该假设一致,我们观察到一些重要的克隆仅在Nivolumab使用后才扩增。应该进行进一步的研究以表征这些T细胞克隆的抗肿瘤免疫力。
除肿瘤内在因素外,肿瘤微环境(TME)也将影响免疫疗法的效果。一项针对TME的研究发现,尽管EGFR驱动基因的改变在肿瘤生长中具有不可避免的作用,但其直接促成非炎症表型的产生,其调节性T细胞(Treg)渗透高而CD8 + T细胞渗透低(27)。对于我们的患者,Nivolumab是在包括EGFR-TKIs,化学疗法和放射疗法在内的多线疗法后才开始使用。因此,我们认为TME的抑制活性增强,并且我们没有对TME进行全面分析。
我们研究的临床意义是深远的。先前的一项研究表明,在EGFR 19号外显子缺失的NSCLC患者中,抗EGFR抗体的滴度最高,这表明该突变具有免疫原性并可以在蛋白质水平表达。我们可以推断,源自EGFR 19号缺失的肽序列(IPVAIKTSPK,AIKTSPKANK)可能是NSCLC癌症疫苗的潜在治疗靶标。此外,HLA-A * 11:01是亚洲人中最常见的HLA-A等位基因。EGFR 19del是NSCLC患者中EGFR突变最常见的突变,约占所有病例的45%,因此,我们的结果可以为同时有EGFR突变和HLA-A * 11:01等位基因的NSCLC患者提供重要的临床数据。

刘莉
华中科技大学同济医学院附属协和医院肿瘤中心
二级教授 主任医师 医学博士 博士生导师
兼任
亚太医学生物免疫学会第二届理事会副理事长
亚太医学生物免疫学会肿瘤学分会副主任委员
中国医促会肿瘤内科分会常务委员
中国老年医学会转化医学专委会副主任委员
中国医药教育协会肺部肿瘤专委会(ACTOS)常务委员
中国医药生物技术协会临床应用专委会常务委员
中国抗癌协会生物治疗专业委员会委员
湖北省医学生物免疫学会理事长
湖北省医学生物免疫学会肿瘤专委会主任委员
湖北省抗癌协会肺癌专业委员会副主任委员
主持国家自然科学基金4项
主持国家科技部国家重点研发计划专项子课题1项
获得湖北省科技进步二等奖1项
国内外发表文章50余篇
Copyright©2021
深圳裕策生物科技有限公司 版权所有
粤ICP备16128839号

